一类医疗器械备案迎来新变化,2022年备案指引
CIO专家-元参
2022年03月02日,国家药监局发布了《关于第一类医疗器械备案有关事项的公告(征求意见稿)》,征求意见截止2022年3月31日。
就此,CIO专家认为上述意见稿中,备案申请资料有了新变化,对企业一类医疗器械委托生产具有较大的参考意义。
理论和实操的矛盾
在现行的《医疗器械监督管理条例》中,医疗器械委托生产,指的是具有医疗器械备案/注册证明的企业,按照委托合同的约定,委托另一家具有生产资质的企业,生产其指定医疗器械的过程。也就是说,企业如果要将一类医疗器械委托生产,只需要提供《第一类医疗器械备案凭证》就可以了。

而实际上,在广东省广州市“第一类医疗器械委托生产备案”申请材料中,还需要委托方提供《第一类医疗器械生产备案凭证》才可以申请,这要求企业不仅需要备案证明,还要具备生产条件。
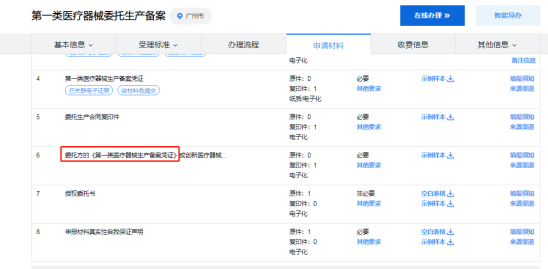
不少客户以为持有一类医疗器械备案证明就可以委托生产了,实际操作起来,发现不少地方要求企业有生产条件,这和现行的法规似乎有所矛盾啊?
委托方也需要具备生产资质吗?
2014年发布的《医疗器械生产监督管理办法》对委托方的资质要求是:委托方应当取得委托生产医疗器械的生产许可或者办理第一类医疗器械生产备案。
小编采访了CIO专家,什么情况下医疗器械可以委托生产?专家表示,当委托方自身产能不足,才允许委托生产,这意味着委托方自己也能够正常生产,而不是仅仅有个备案凭证,就可以办理委托生产了。此外在实际操作中,如果委托方自己都不具备生产条件,是无法完成委托生产产品和自产产品的对比评价,这也和法规中的“保证出厂的医疗器械符合强制性标准以及经注册或者备案的产品技术要求”相违背。
医疗器械注册人制度下,医疗器械注册人/备案人不需要具备生产资质,可以首次申请《第一类医疗器械备案凭证》基础下,进行委托生产,但是具体指导文件还未出台,各地暂时还只有首次申请二类、三类医疗器械注册时,进行委托生产的办事指南,一类医疗器械首次备案并委托生产,实际暂未开放。
为什么现在又不需要了?
回到最近新发布的征求意见稿上,第一类医疗器械备案资料要求如下:
1、第一类医疗器械备案表
2、委托其他企业生产的,应当提供受托企业资格文件(营业执照副本复印件)、委托合同和质量协议。
3、产品技术要求
4、产品检验报告
5、产品说明书及最小销售单元标签设计样稿
6、生产制造信息
7、符合性声明
上述资料并未要求医疗器械的生产许可或者办理第一类医疗器械生产备案,未来各地的委托生产备案也会相继开放!笔者专业有限,欢迎大家一起讨论。
医疗器械委托生产制度的建立,规范了委托生产双方责任,放开委托生产,盘活了资源,避免生产设施设备闲置,社会分工更细化,各企业间优势互补,鼓励企业创新。而委托双方在履行生产质量管理规范时缺乏衔接,委托生产有较大风险,这是目前委托方需要取得生产资质证明的原因。
笔者认为,医疗器械产品风险如何确认和控制?医疗器械应该在被委托方的生产条件下能够有效地加以确认,而不是在委托方的生产条件下加以确认,即便委托方已经取得生产资质证明,也不能保证医疗器械在受托方环境下就能生产出一样的产品,所以降低委托方的门槛,也许更有利于双方在生产上的衔接合作,只要受托方按照产品技术说明要求进行生产,符合GMP标准,不必再对比委托方的生产环境,更有利于医疗器械市场的资源灵活配置。
实际工作中医疗器械生产企业如果想委托生产或受托生产,该如何操作?
1. 签订委托生产合同。如何保障委托协议万无一失,关注笔者下一篇文章。
2. 委托方办理委托生产备案,向所在地备案(第二、三类省局,第一类市局)。
3. 受托方应办理生产许可或者备案变更(向谁备案同上)。
4. 受托生产出口产品的,应在产品出口前备案。
CIO合规保证组织,为医疗器械企业提供第一类医疗器械产品首次备案、变更等业务合规支持,深入解读2022政策法规,帮助企业产品快速上市,合规管理医疗器械生命全周期。
相关文件下载、服务及学习课程:
合规文库:关于第一类医疗器械备案有关事项的公告(征求意见稿)
合规服务:第一类医疗器械产品备案服务
联系专家,获取专家指导意见:e邀专家
























