北京市药品监督管理局关于组织开展生物制品分段生产需求调查的通知
政策公告 企业 北京市
各相关药品上市许可持有人,药品研制机构:
根据《国家药监局关于印发生物制品分段生产试点工作方案的通知》(国药监药管〔2024〕24号)相关要求,现组织我市药品上市许可持有人和药品研制机构开展生物制品分段生产需求调查。具体内容如下:
一、调查时间
2024年11月8日至2024年11月30日。
二、调查内容
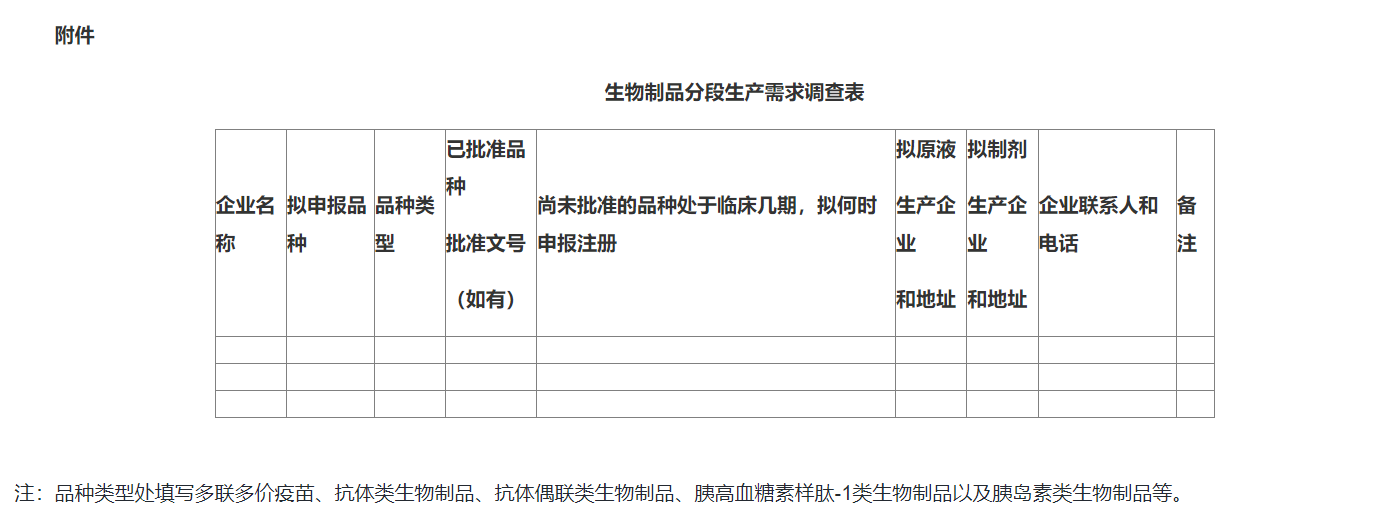
拟申报生物制品分段生产的药品上市许可持有人和药品研制机构名称、品种名称等,详见附件。
三、申报要求
拟开展生物制品分段生产的企业和品种应满足国家药监局生物制品分段生产试点工作方案相关要求:
(一)试点企业
试点品种的持有人应当具备试点品种的自主研发、质量管理、风险防控和责任赔偿能力,持有人及分段生产的相关受托生产企业应当执行统一的质量管理体系。参加试点工作的受托生产企业应当具备完善的药品质量保证体系,具有三年以上生物制品商业化生产经验。
(二)试点品种
试点品种原则上应当为创新生物制品、临床急需生物制品或者国家药监局规定的其他生物制品,包括多联多价疫苗、抗体类生物制品、抗体偶联类生物制品、胰高血糖素样肽-1类生物制品以及胰岛素类生物制品等。
四、其他要求
(一)请拟开展生物制品分段生产的持有人和药品研制机构认真学习国家药监局生物制品分段生产试点工作方案,方案详见国家药监局网站(https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20241022112249149.html)。
(二)请拟开展生物制品分段生产的持有人和药品研制机构填写“生物制品分段生产需求调查表”(见附件),并于2024年11月30日前上报。
(三)药品上市许可持有人请按时将调查表报所在分局和市药监局药品生产处。药品生产处联系人:刘琨,联系电话:55526926。
(四)药品研制机构请按时将调查表报市药监局药品注册处。药品注册处联系人:马书章,联系电话:55526917。
特此通知。
附件:生物制品分段生产需求调查表
北京市药品监督管理局
2024年11月8日
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习。






















