儿童化妆品技术指导原则:儿童不建议使用喷雾防晒、高倍防晒产品
CIO专家-元参
近日,《儿童化妆品技术指导原则(征求意见稿)》发布,防晒类儿童化妆品受到格外关注。自从儿童化妆品法规陆续出台后,小编发现已经有不少备案注册号撤回,部分产品下架,大牌企业纷纷改变市场布局,转战其他护肤领域。那么在本次征求意见稿中,防晒类儿童化妆品有什么新监管要求?网络上各种声音,“喷雾防晒凉了”“儿童防晒市场没了”是否真的呢?和CIO合规保证组织小编一起探讨,欢迎指出不当。
一、不建议对儿童使用喷雾型防晒化妆品
征求意见稿原文:不建议对儿童使用喷雾型防晒化妆品,如必须使用的,应当充分考虑吸入风险,在使用方法中标识“请勿直接喷于面部”“请先喷于手掌、再涂抹于面部”“避免吸入”等类似警示用语。
防晒喷雾在使用时容易被意外吸入,可能会刺激肺部,诱发疾病,应避免对儿童使用这类产品。对儿童而言,含有氧化锌的物理性防晒霜更为安全。小编发现,目前市场上还是有大量儿童防晒喷雾在销售,月销量过10万,其中不乏知名品牌。
此外,部分喷雾方式属于压力灌装溶胶等易燃性产品,有易燃易爆危险。征求意见稿对此要求:应当标注“注意防火防爆”等内容,或者以图示形式警示。
二、儿童化妆品不得宣称“高倍防晒”
征求意见稿原文:儿童化妆品不得宣称“高倍防晒”,不得有鼓励暴晒的宣称,如有效抵抗XX小时紫外线辐射、有效降低XX%紫外线损伤、提供XX倍防护能力等。
不少消费者对“高倍防晒”理解有误,认为防晒值越高防晒效果越好。其实,产品的spf值越高,防护时间越长,而产品吸收紫外线的能力却没有太大增长。此外,产品的spf值过高会增加皮肤负担,引发刺激、过敏等皮肤问题。SPF50的防晒霜对儿童的肌肤有较强的刺激性,最好不要选购。
三、标注26种“含致敏性组分”
征求意见稿原文:对使用含有26种致敏性组分香精或者香料,按照第3.2部分要求应当在标签标印警示用语的,以“含致敏性组分”为引导语,标注具体的致敏性组分名称等。
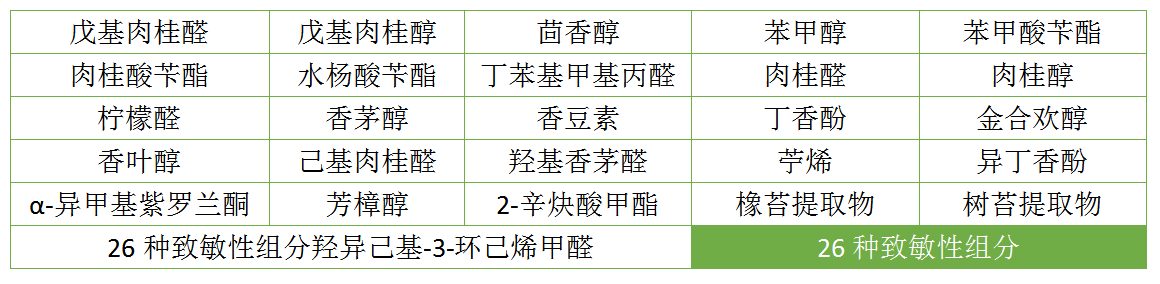
儿童化妆品的配方研发应减少使用香精、着色剂、防腐剂以及表面活性剂等原料,以降低产品对儿童皮肤产生刺激的风险。
四、化学防晒剂使用
征求意见稿原文:原则上化学防晒剂种类不得多于3种(不含3种)且使用量应当低于成人用量,二氧化钛、氧化锌同时作为防晒剂或其他目的使用时,其总使用量不得超过25%,且SPF值不宜高于30。
五、儿童化妆品PH值
征求意见稿原文:原则上,儿童化妆品应当设置pH值范围(无法测定pH值的剂型除外),pH值范围应当在4.5~7.0(含4.5以及7.0)。
以洗发水、沐浴露为例,儿童的皮肤PH值是弱酸性的,需要使用的也是略偏酸性的洗浴用品,以天然、无刺激为前提。而大人的是中性以及偏碱性的居多,因为大人使用的洗发水、沐浴露是为了更好地清洁。
在这个庞大的市场需求下,国家也正在不断地加码对儿童化妆品安全的监管,从研发到销售终端进行闭环式监管,相信儿童化妆品市场的独立监管时代即将到来。
CIO合规保证组织以“让医药更可靠、让大众更放心”为使命,以独立第三方的身份,客观公正诚信,积极参与医药领域的社会共治,提升人民群众使用药品、医疗器械、化妆品、保健食品等产品的安全性和有效性,成为保障人民群众用药安全的能手、政府科学监管的助手、企业合规管理的帮手、从业者提升合规能力的推手,不断增强人民群众的获得感、幸福感和安全感。
如果您有儿童化妆品注册、生产和经营合规需求,可以点击下方联系我们。
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






