儿童化妆品配方设计合规指引
CIO专家-元参
4月11日,中国食品药品检定研究院发布了关于公开征求《儿童化妆品技术指导原则(征求意见稿)》意见的通知。CIO合规保证组织小编准备了儿童化妆品配方设计合规指引。
一、配方极简,并非限制原料种类数量
儿童化妆品的配方设计应当遵循安全优先原则、功效必需原则、配方极简原则,其中配方极简原则为相对性原则,并非限制原料种类数量。化妆品注册人、备案人应当在产品配方设计时充分考虑上述原则,并在产品安全评估报告的“配方设计原则”中充分体现产品配方的科学合理性。
举例:
本配方精选已知安全、温和且纯度高的化妆品常用原料,使用尽量少的原料品种及添加量(水除外)。
本产品的基本功能为滋润与保湿,配方不使用超出这两点基本功能的其他功效添加成分(必要的乳化剂、稳定剂等除外)。
二、配方不得有这些原料
参考《化妆品禁限用原料目录》,以下列举部分不得使用原料:烟酰胺、熊果苷、咖啡因等常见功效成分,含致癌性风险成分如甲醛,碘丙炔醇丁基氨甲酸酯(沐浴产品和香波除外),常见祛痘成分如水杨酸及其盐类(香波除外)、沉积在二氧化钛上的氯化银等。
儿童化妆品应当选用有安全使用历史的化妆品原料,不得使用尚在安全监测中化妆品新原料,不得使用对儿童安全性尚不明确的原料;不允许使用基因技术、纳米技术等新技术制备的原料,如无替代原料必须使用时,应当在产品安全评估资料中说明原因,并针对儿童化妆品使用的安全性进行充分评价。
儿童化妆品及其所用的原料应当符合《化妆品安全技术规范》的相关要求,不得使用《化妆品安全技术规范》等国家强制标准中明确规定禁用于儿童化妆品的原料;不宜使用可能有致癌性风险的原料如甲醛释放体;此外,对使用人群含“婴幼儿”的儿童化妆品,不得使用碘丙炔醇丁基氨甲酸酯(沐浴产品和香波除外)、水杨酸及其盐类(香波除外)、沉积在二氧化钛上的氯化银等原料。
儿童化妆品不允许使用以祛斑美白、祛痘、脱毛、除臭、去屑、防脱发、染发、烫发等为主要目的的原料,如因其他目的使用可能具有上述功效的原料时,应当对使用的必要性及针对儿童化妆品使用的安全性进行评价。
三、香精、着色剂、防腐剂、表面活性剂
儿童化妆品的配方研发应当减少配方所用原料的种类,并结合儿童生理特点,从原料的安全、稳定、功能、配伍等方面评估所用原料的科学性和必要性,特别是香精、着色剂、防腐剂以及表面活性剂等原料。
1)香精
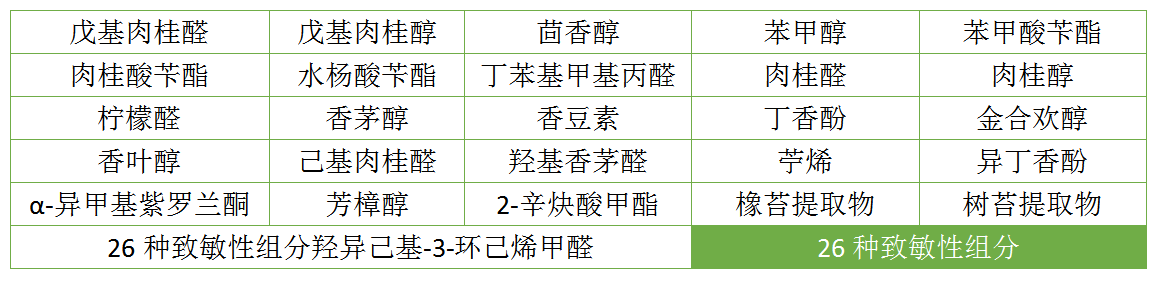
儿童化妆品配方应当尽可能不用或者少用香精或者香料,不建议使用成分复杂的可能含有26种致敏性组分(详见附表)的原料作为芳香剂。如使用含有26种致敏性组分的香精或者香料,应当进行充分安全评估,对致敏性组分含量在驻留类产品中大于等于0.001%,以及在淋洗类产品中大于等于0.01%时,应当在标签上标印以告知消费者。
2)着色剂
儿童化妆品配方应当尽可能不用或者少用着色剂。使用3种以上着色剂时(不含3种),应当说明所用原料种类、用量的科学性和必要性,开展相关研究确保产品使用安全,必要时,提交人体试用试验数据作为证据支持。
3)防腐剂
儿童化妆品应当尽可能少用防腐剂。淋洗类产品的防腐剂用量应当低于《化妆品安全技术规范》的限量要求;驻留类产品的防腐剂用量接近《化妆品安全技术规范》的限量时(如90%以上),或者使用3种以上防腐剂(不含3种)时,应当提供相关科学依据以说明所用原料种类、用量的科学性和必要性,必要时,提交配方优化过程的研究数据作为证据支持。
4)表面活性剂
儿童化妆品应当尽可能少用表面活性剂,特别是阳离子表面活性剂和透皮促进剂等。对于使用诸如阳离子表面活性剂、透皮吸收剂等原料的产品,应当对其使用的科学性和必要性进行分析,提供相关的安全性方面的资料。
5)使用了限用原料,怎么处理?
“儿童不宜常用”
“应使粉末远离儿童的鼻和口”
“防止儿童抓拿”
对使用人群含 “儿童”(3周岁-12周岁)的化妆品,使用限用组分时,应当在标签上标印相应的使用条件和注意事项,例如使用氯化锶,应当标印“儿童不宜常用”;使用滑石:水合硅酸镁,应当标印“应使粉末远离儿童的鼻和口”;使用氢氧化钙、氢氧化锂、碱金属的硫化物类、巯基乙酸及其盐类、巯基乙酸酯类、碱土金属的硫化物类、氢氧化锶、氢氧化钾(或氢氧化钠)等原料,应当在标签上标印“防止儿童抓拿”。
CIO合规保证组织以“让医药更可靠、让大众更放心”为使命,以独立第三方的身份,客观公正诚信,积极参与医药领域的社会共治,提升人民群众使用药品、医疗器械、化妆品、保健食品等产品的安全性和有效性,成为保障人民群众用药安全的能手、政府科学监管的助手、企业合规管理的帮手、从业者提升合规能力的推手,不断增强人民群众的获得感、幸福感和安全感。
如果您对儿童化妆品配方设计、化妆品注册备案感兴趣,点击下方联系我们。
相关文件下载、服务及学习课程:
合规文库:《儿童化妆品监督管理规定》2022年1月1日起施行
合规培训:儿童化妆品注册备案要求与监管重点介绍
合规服务:化妆品原料安全信息报送
联系专家,获取专家指导意见:e邀专家
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






