体外诊断试剂GMP厂房设置有哪些基本要求?
CIO专家-甘露子
笔者就多年的体外诊断试剂生产厂房建设、使用经历,与大家分享一点心得体会,从法规依据、洁净厂房建设、布局和微生物检验室四个方面来讲解。
一、体外诊断试剂厂房设施建设的法规依据
当前体外诊断试剂(以下简称IVD)产品的厂房设施,是按《医疗器械生产质量管理规范附录体外诊断试剂》(以下简称《规范附录》)、《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》(以下简称《原则》)、《无菌医疗器具生产管理规范》(YY0033-2000)、《医药工业洁净厂房设计标准》(GB 50457)中有关要求建设,主要分为以下两种情况:
1、不需要净化生产条件的情形
此类产品为普通类化学试剂,如通过氧化还原反应来实现检测功能的试剂产品、电解质分析仪随机试剂、生化分析仪用稀释液、清洗液、血液分析仪用稀释液、溶血剂等。通常主要由普通化学试剂构成,不含蛋白质、核酸等生物活性物质,其特点是试剂较稳定,不易受环境温度、湿度、洁净度、微生物等的影响。例如:无机离子(铝、镉等)测定试剂盒、白蛋白测定试剂盒(溴甲酚绿法)。
无需净化生产条件的IVD产品,应当在清洁环境内进行生产。清洁条件的基本要求详见《规范附录》2.2.23条,或《原则》2.30.1条要求。在此,本文不再赘述。
2、需要净化生产条件的情形
1)酶联免疫吸附试验试剂、免疫荧光试剂、免疫发光试剂、聚合酶链反应(PCR)试剂、金标试剂、干化学法试剂、细胞培养基、校准品与质控品、酶类、抗原、抗体和其他活性类组分的配制及分装等产品的配液、包被、分装、点膜、干燥、切割、贴膜以及内包装等,生产区域应当不低于100,000级洁净度级别。
——“酶联免疫吸附试验试剂、免疫荧光试剂、免疫发光试剂、聚合酶链反应(PCR)试剂、金标试剂、干化学法试剂、细胞培养基、校准品与质控品”宜理解为产品。
——“酶类、抗原、抗体和其他活性类组分”宜理解为以上成品中涉及的原料。
——“配液、包被、分装、点膜、干燥、切割、贴膜以及内包装”指具体工艺。
即以上成品中涉及酶类、抗原、抗体和其他活性类组分的配液、包被、分装、点膜、干燥、切割、贴膜以及内包装工艺过程的应在不低于100,000级洁净度级别的生产区域内进行操作。
2)阴性或阳性血清、质粒或血液制品等的处理操作,生产区域应当不低于10,000级洁净度级别,并应当与相邻区域保持相对负压。
3)无菌物料等分装处理操作,操作区域应当符合局部100级洁净度级别。
——通常只有培养基类产品才有无菌要求。
二、洁净厂房建设的基本要求
1、选址
厂区应尽量的选择在卫生条件较好、空气清新、大气含尘及含菌浓度低、无有害性气体等周围环境较为清洁和绿化较好的地区,不要选在多风沙的地区和有严重灰尘、烟气、腐蚀性气体污染的工业区。厂区应远离铁路、码头、飞机场、交通要道以及散发大量粉尘和有害气体的工厂、贮仓、堆场等有严重空气污染、振动或噪声干扰的区域。如不能远离严重空气污染源时,则要在其全年主导风向的上风侧。洁净厂房净化空气调节系统的新风口与交通主干道近基地侧道路红线之间的距离宜大于50m。生产企业厂区内主要道路应宽畅,路面平整,并选择不易起尘的材料建造。不论是新建或改建的洁净车间周围都要进行绿化,四周应无积水、无垃圾、无杂草等。
2、洁净室环境控制要求
1)不同洁净室(区)空气洁净度级别要求
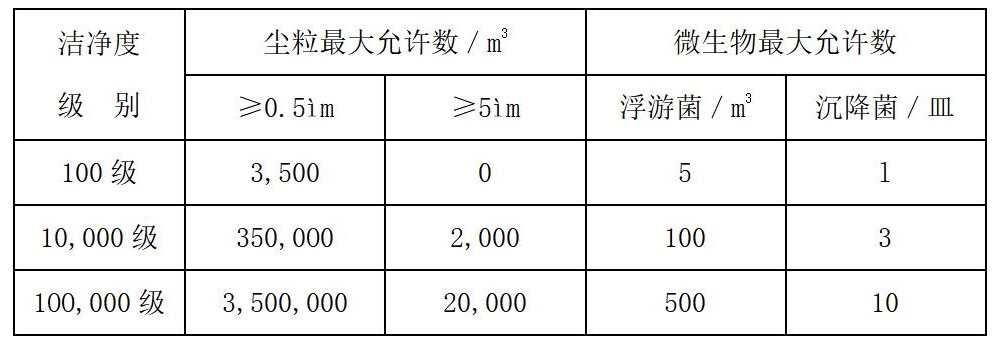
2)洁净室温、湿度要求
无特殊要求时,温度应当控制在18~28℃,相对湿度控制在45%~65%。有特殊要求的,根据产品工艺特点确定。
3)压差
空气洁净级别不同的洁净室(区)之间的静压差应当大于5帕,洁净室(区)与室外大气的静压差应大于10帕。
相同级别洁净室间的压差梯度应当合理。这里“合理”的压差梯度:1~3Pa。
4)换气次数
10 000级:≥20次/小时
100 000级:≥15次/小时
5)风速
水平层流:≥0.4 m/s
垂直层流:≥0.3 m/s
6)其它
①洁净室(区)内的人数应当与洁净室(区)面积相适应。
一般按洁净区设计人数按平均每人2~4㎡计算。
洁净室里的新鲜空气量,应取下列最大值:a)补偿室内排风量和保持室内正压所需新鲜空气量;b)室内每人新鲜空气不应小于40m3/h。
理论推导举例(验证思路仅供参考):
100,000级,房间高度2.5m,换气次数18次/小时,新风量取20%,每人最低需要面积:
40m3÷20%÷18÷2.5m=4.44㎡
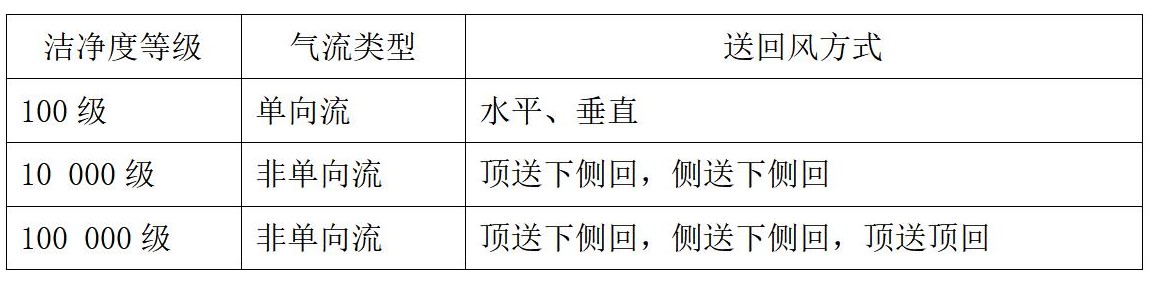
②洁净室气流的送、回风方式
3、布局
1)按生产工艺流程布置。流程尽可能短,减少交叉往复,人流、物流走向合理。应配备人员净化室、物料净化室,除配备产品工序要求的用室外,还应配备洁具室、洗衣间、暂存室、工位器具清洗间等,每间用室相互独立,洁净车间的面积应在保证基本要求前提下,与生产规模相适应。
2)洁净室(区)和非洁净室(区)之间应有缓冲设施,如气闸室(带互锁装置)。
3)洁净室(区)内的水池、地漏应安装防止倒灌的装置,避免对环境和物料造成污染。100级的洁净室(区)内不得设置地漏。
4)产尘操作的洁净室,推荐设计为相对负压并全排。如有其它有效的防尘方法,也可采用。
5)对具有污染性、传染性和高生物活性的物料应当在受控条件下进行处理,避免造成传染、污染或泄漏等。
——污染性或传染性物料一般指活/灭活菌株、活/灭活/减活毒株、致病病原体阳性的血液及其他阳性体液、有毒有害的化学原料、染色剂等。
——高生物活性的物料主要指高生物活性蛋白,如效价较高的蛋白酶类、抗原、抗体等。
——受控措施通常针对物料的特性采取有效的应对手段,如在负压保护环境内操作、独立设置排风、排出的空气经过过滤等无害处理后再排出室外等。
6)生产激素类、操作有致病性病原体或芽胞菌制品的,应当使用单独的空气净化系统,与相邻区域保持负压,排出的空气不能循环使用。
——此处所指的激素类产品,其实是指激素的合成过程。如果是使用外购的激素用于生产,则不能算作生产激素类制品,如,用外购的HCG标准品加入缓冲液中制备质控品,就不能算是生产激素类制品。
——操作有致病病原体的,应使用单独、与相邻区域保持相对负压、全排风的净化车间。
7)进行危险度二级及以上的病原体操作应当配备生物安全柜,空气应当进行过滤处理后方可排出。
——病原体危险度可参考《人间传染的病原微生物名录》。
8)生产聚合酶链反应(PCR)试剂的,其生产和检验应当在独立的建筑物或空间内,保证空气不直接联通,防止扩增时形成的气溶胶造成交叉污染。
9)特殊物料生产操作环境控制要求总结建议
——阴性或阳性血清、质粒或血液制品等的处理操作,生产区域不低于10,000级洁净度级别,单独的空气净化系统,配备生物安全柜,操作间与相邻区域保持相对负压,全排风。
注:阴、阳性血清中也可能含有致病性病原体。
——操作有致病性病原体或芽胞菌制品,生产区域不低于10,000级洁净度级别,单独的空气净化系统,配备生物安全柜,操作间与相邻区域保持相对负压,全排风。
——生产激素类制品,生产区域不低于100,000级洁净度级别,单独的空气净化系统,操作间与相邻区域保持相对负压,全排风。
——酶制剂、产尘、易挥发产品操作时,或产生有害物质的,操作间与相邻区域保持相对负压,且操作间排风单独全排。
——有无菌操作要求的,可在100,000级洁净室内设置100级层流罩或超净工作台。
四、关于微生物检验室的设置要求
1、产品有无菌要求的,如培养基类产品,应设置
无菌检验室:独立空调系统,10,000级条件下局部100级,可循环风。
微生物限度室:独立空调系统,10,000级条件下局部100级,可循环风。
阳性对照室:独立空调系统,10,000级条件,配生物安全柜,全排风。
说明:当无菌检验室和微生物限度室共用空调系统时,微生物限度室应采用全排风。
2、非无菌要求的产品,只检测工艺用水和洁净环境微生物,应设置
微生物限度室:独立空调系统,10,000级条件下局部100级,循环风。
阳性对照室:独立空调系统,10, 000级条件下局部100级,全排风。
说明:不同地方,可能有不同要求,如北京市《医疗器械洁净室(区)检查要点指南(2013版)》中要求:生产体外诊断试剂的生产企业是否建立了微生物实验室,用于环境和水质监测。
相关文件下载、服务及学习课程:
合规培训:GMP基础知识培训
合规服务:GMP车间设计图纸审评服务
联系专家,获取专家指导意见:e邀专家
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。







