QC现场检查迎检准备清单(下)
CIO专家-山丹
在上篇的QC迎检准备清单中,笔者详细地梳理了现场准备、数据可靠性、人员及常用文件清单、台账和检验原始记录等迎检的准备工作与流程,旨在帮助大家提升迎检质量与效率。在本文中将会继续对现场迎检中的其他各项准备工作进行介绍。
6 方法验证资料、申报资料中药学研究部分及设备验证
6.1 安排熟悉的人员再次熟悉各个项目的分析方法验证资料,以备审计官查看时,熟练回答问题。
近来,审计官对于产品的清洁分析方法验证的关注度逐步提高,所以除了日常的有关物质分析方法验证、含量分析方法验证、溶出度分析方法验证、残留溶剂分析方法验证、粒度分析方法验证、红外分析方法验证、紫外分析方法验证之外,还需要重点关注和准备清洁分析方法验证相关资料。
6.2 审计前一定要把申报资料与现场的SOP、检验数据、稳定性考察、方法验证等资料再次核对,以应对申报资料在撰写过程中可能出现的错误/笔误、混淆等意外情况,如果发现其与现场文件有不一致或者矛盾或者写错之处,应及时确定正确性之后通过勘误或CAPA进行纠正与处理,以备检查。
6.3 准备并熟悉常用检验设备/仪器的验证资料(HPLC、UV、IR、GC等等)。
7 实验室偏差、OOS、异常调查相关准备
7.1 整理审计品种相关的偏差、OOS、异常台账;
7.2 再次检查历史调查的完整性及逻辑性,是否找出根本原因?采取的CAPA是否有针对性?是否有效?是否持续执行?
7.3 如果发现以前的调查不完整或者未找见根本原因,建议可发起补充调查,通过有针对性的假设试验查找根本原因,最终采取有效的CAPA,预防同样的问题重复发生。
8 现场操作注意事项
8.1 称量操作注意事项:
1)检查并确保称量前电子天平的已经完成校准,严格按照SOP要求进行操作;
2)称量时严禁裸手,一定要戴手套,相关的记录放在现场,称量完及时同步记录;
3)天平的三个门(左、右、上)都要关严,防止气流等干扰;
4)称量容易吸潮的供试品和对照品一定要快,不要反复称量、不要人为的导致其吸潮(必要时控制湿度);
5)提前熟悉“天平最小值”的周期以及相关文件。
8.2 供试品处理注意事项(主要项目)
1)有关物质:主要防止实验室的外源性污染。
2)含量测定:主要确保供试品能够完全溶解和防止污染。
3)溶出度:除了药典上规定的注意点,检测过程中还要观察溶出现象及异常情况。
4)溶剂残留:供试品与对照品尽量不要在同一区域配制,防止污染等等。
5)水分:要控制检测环境的湿度,关注费休氏液的强度等。
8.3 液相等仪器操作注意:
1)检查实验室仪器的标识与设备状态、校准是否还在范围内;
2)提前检查并确保动态生产批检验用到的仪器等均能良好运行;
3)如有动态生产批次的检验工作,提前2天将HPLC系统及所需要的检测仪器清洗干净待用;
4)如有动态生产批次的检验工作,提前将有关物质等检验用色谱柱用空白溶剂进样清洗,确保无残留、污染等;
5)提前把中试、验证批、稳定性的图谱看一看,是否能够第一时间找到,建议直接用表格将序列统计出来,以备快速的找到相应数据与序列;
6)动态批检验时注意供试品中是否有异常峰等,每针走完及时计算结果;
7)熟悉数据完整性要求,严禁使用他人账户登录,如果他人的账户正在登录,快速找见当事人退出后,再登录自己的账户;
8)在审计官要求查看图谱或者审计追踪时候,登录时应用身体或者手遮挡密码的输入过程;
9)审计官要求看的电子图谱和审计追踪应能立即找出(岗位专人提前练习);
10)仪器、色谱柱等使用台账一定要同步填写。
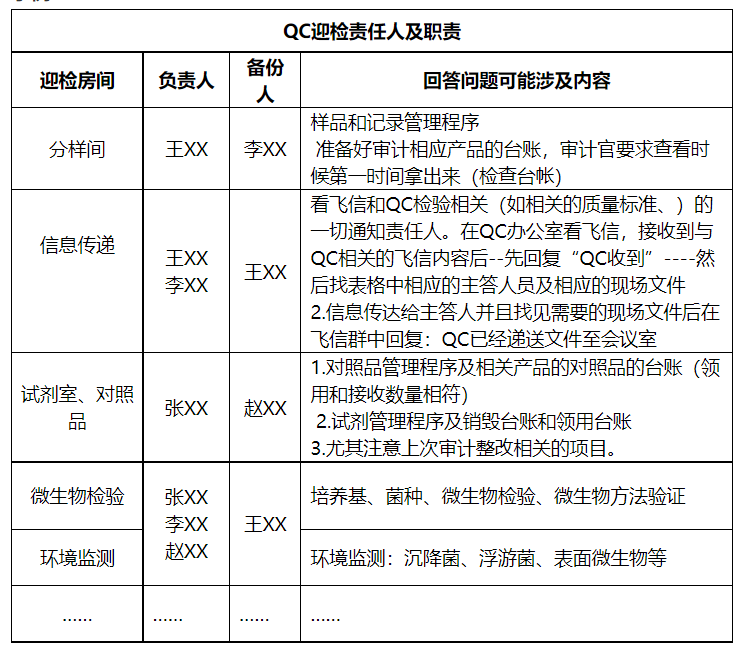
9 制定各区域迎检清单
结合审计范围制定与之相关的QC审计迎检责任人及各区域迎检清单,使人员各自熟悉各自在迎检中的角色和职责,同时连接需要沟通和交流的对象,便于审计当中快速、流畅、专业的提供资料及专业的解答审计官的问题。
示例:
10 回答审计官问题
10.1 遇到审计官,微笑并打招呼。
10.2 回答问题时,一定要微笑面对审计官回答。
按照SOP…..可以看着SOP或者规程说。如果文件不在,熟悉文件的可以直接说;紧张的或者不太熟悉的,可以给审计官说一下:不好意思,请稍等或其他等等。然后迅速的去拿SOP;
10.3 审计官问什么,答什么。
不知道的可以说稍等,我去拿一下相关的SOP等等。
10.4 每个迎检人员在自己的区域内一定要熟悉物品的放置和SOP的放置。
10.5 传递给审计官的所有文件、记录一定要再仔细看一遍。
是否有未签字或者铅笔痕迹。
一份有效的审计迎检准备清单,不光能提高基层人员认识,也能提高准备工作的质量与效率,逐步形成一个流程化、系统化、常态化的工作流,顺畅专业的迎检流程也能提升审计官对企业的认同感和信任感。也希望经过多次各种检查的洗礼和磨砺,提升人员的质量控制理念与认识,各企业的实验室管理水平都持续不断完善。假如您打算邀请第三方咨询服务公司帮助进行药品GMP合规审计,欢迎随时联系我们,CIO合规保证组织将竭诚为您服务!
*本文来源 - - GMP辞海微信公众号
相关文件下载、服务及学习课程:
合规文库:药品生产质量管理规范
合规培训:药品GMP自检法规及要点解析
委托定制:GMP合规审计(符合性检查)
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点。本文为转载文章,版权归原作者所有,如涉侵权,请联系我们删除。
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






