创新药生命周期管理-Why?What?How?
CIO专家-山丹
引言
在当今竞争激烈、不断变化的制药市场环境中,品牌药物所有者越来越致力于开发综合生命周期管理策略,以实现其产品组合中每种产品的最大收益,并确保其继续能够找到将为更多患者带来实际效益的新治疗方法。
不同的产品和市场的生命周期将有所不同。本文回答创新药的生命周期的三个问题:Why?What?How?并举例说明。
生命周期管理-Why?
生命周期管理(Life cycle management, LCM)对于制药公司最大化其产品的价值和生命周期至关重要。其涉及到从药物的初始开发到最终退出的整个生命周期中的战略规划和执行。
最大化收入和市场份额:生命周期管理使制药公司能够延长其产品的商业寿命,最大化收入和市场份额。通过实施诸如产品线扩展、新适应症和改良等策略,公司可以开拓新的患者人群并扩大其市场覆盖范围。
应对不断变化的市场动态:制药行业不断发展,出现新的竞争对手、新兴技术和不断变化的患者需求。生命周期管理使企业能够通过引入满足不断变化的患者偏好和市场需求的创新特性、剂型或递送系统来适应这些变化并保持竞争力。
监管和市场准入:监管机构要求制药公司持续监测和更新其产品的安全性、有效性和质量特征。生命周期管理确保符合监管要求,包括后市场研究、标签更新和安全监测,以维持监管批准并确保市场准入。
增加患者获得创新疗法的机会:生命周期管理策略还可以改善患者获得创新疗法的机会。通过获得新的适应症或在特定患者人群中进行临床试验,公司可以扩大治疗选择,解决未满足的医疗需求,并改善患者预后。
延长专利保护期和管理仿制药竞争:专利保护对于制药公司收回其研究和开发投资至关重要。生命周期管理包括延长专利保护期的策略,例如为新适应症或配方获得额外的专利。这有助于公司推迟仿制药竞争并保持市场排他性,使其能够继续从其产品中产生收入。
可持续的业务增长:有效的生命周期管理有助于制药公司实现可持续增长。通过优化现有产品的价值,公司可以为新疗法的研究和开发分配资源,确保创新药物的持续流水线。
生命周期管理-What?
药品产品生命周期分为五个不同的阶段:产品开发、引入(随着产品在市场上的推出而销售缓慢增长)、成长、成熟和衰退。如下图所示,在开发候选药物获得批准并成为上市产品之前,它不会产生收入。根据20年专利期限,创新公司有一个有限的时间窗口来收回其研发投资并获得利润,这些利润还必须支持未能产生上市产品的研发工作。LCM策略旨在延长这个时间窗口,并且规划始于最初候选人开发期间(即在药物发现期间)。随着对药物候选药物和可能从药物中受益的患者人群了解得更多,这些策略会不断演变,并且那些具有最高技术成功概率的策略将作为研发和商业策略的一部分推进。
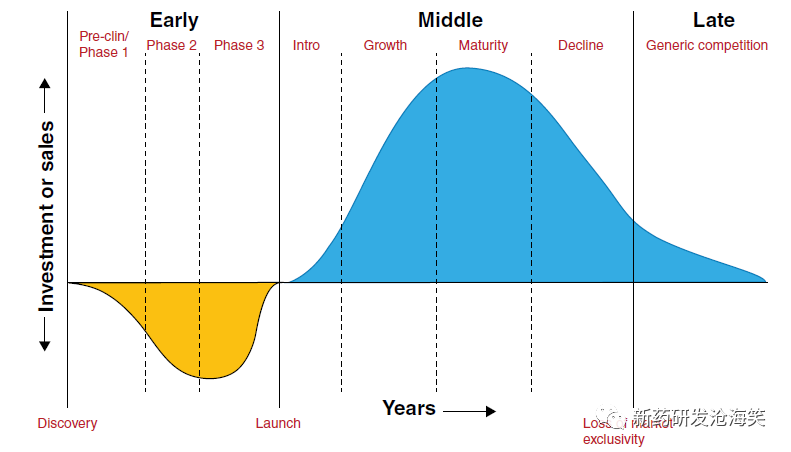
药品生命周期与产品成熟度和市场表现的关系
生命周期管理-How?
常用的生命周期管理策略包括:新适应症、新配方、儿童市场排他性、疾病管理计划、战略性定价变化、授权仿制药、组合产品、下一代产品、新剂量方案、专利诉讼、处方转非处方。选择要采取的策略在很大程度上取决于药物候选药物的属性以及市场评估。机会评估的大部分工作都发生在药物开发过程的早期,并且通常在最初的目标产品概要中在某种程度上表达。关于化合物属性和基本特征,如药物的理化特性(例如分子量、渗透性和溶解度)将为可能或不可能的给药途径提供指导(例如经皮或眼用给药)。生理和ADME参数,如前系统代谢、特定部位吸收等,将确定是否可能使用新型口服给药系统(例如快速溶解片或延长释放制剂)。药理学数据,如药物作用的敏感性和特异性以及所谓的“非靶效应”的存在或缺失,可能会揭示药物协同作用和组合产品潜力以及额外目标人群和适应症的潜力。最后,对市场的了解可以提供有关某些给药途径、配方和利益:风险特征对于LCM策略可能针对的感兴趣人群提供数据。所有这些因素都影响整体LCM策略。
案例1:
AstraZeneca的下一代Prilosec(奥美拉唑)到Nexium(埃索美拉唑)的转换是行业范例。奥美拉唑和埃索美拉唑在化学水平上几乎相同,具有相同的副作用和药物相互作用,AstraZeneca及时向FDA提交了Nexium,并成功地说服了美国专利局,认为Nexium与Prilosec有很大不同,因此应该被授予自己的专利,并获得20年的保护,在2001年将40%的Prilosec患者转移到Nexium。
尽管有人声称Nexium本来就不应该首次获得批准,但许多人认为Prilosec-Nexium手性转换是理想的,包括Agranat、Caner和Caldwell在其评论中写道:“当拥有外消旋体的所有者开发手性转换时,单一对映体在外消旋体专利到期之前进入市场是有优势的,并且在各自的仿制药进入市场之前。”
然而,“紫色药丸”营销计划非常成功!当FDA批准通过时,美国历史上最大规模的营销活动之一开始了。该公司在直接面向消费者的营销、医院对该药物的折扣、医生办公室的免费样品和媒体广告方面花费了5亿美元。其营销努力导致大量患者转移到具有新专利的下一代产品,从而防止了仿制药占据AstraZeneca肠胃市场份额的大部分能力。
AstraZeneca还将Prilosec转换为OTC药物,因处方下降而转换。在过去的十年中,它为AstraZeneca赚取了近500亿美元。Nexium背后的策略称为“专利延期”——一种增加初始发现公司对特定药物“垄断”时间的策略。
案例2:
Humira (adalimumab, 阿达木单抗)最初是由英国的Cambridge Antibody Technology和BASF联合风险投资开发。2000年,Abbott以69亿美元收购了德国化学公司BASF的制药业务。当时,Abbott因没有任何畅销药物而受到许多投资银行的批评。Abbott希望该药能成为所需的畅销药物。2013年,Abbott分为两家公司,制药公司取名为AbbVie。Humira转移到AbbVie,至今仍在该公司。
像Humira这样用于需要持续治疗的慢性终身疾病和患者人群众多的药物,生命周期规划是这种药物成功的关键因素,Barbara Gilmore, Frost & Sullivan的资深分析员回顾该药物的临床开发时,“AbbVie的生命周期管理和对多种适应症进行临床试验的投资对该药物的成功至关重要。” 该药物已获得多种不同适应症的批准,包括类风湿性关节炎(2003年),银屑病性关节炎(2005年)和成人克罗恩病(2007年),此外还有强直性脊柱炎、银屑病、克罗恩病、溃疡性结肠炎、斑块状银屑病、化脓性汗腺炎和葡萄膜炎。除了适应症拓展,还扩展了使用人群,包括少年特发性关节炎,以及老年人群。化脓性汗腺炎属于罕见病。阿达木单抗获此“孤儿药”的适应症。当这些疾病的新适应症获得批准时,即使其他适应症失去了排他性,孤儿药物也可以获得该特定孤儿适应症的额外七年排他性。
对于Humira,采用高效的营销策略也对AbbVie有益。 Gilmore说:“当你考虑这些适应症的市场营销时,你会发现只需要接触的专科只有几个,这意味着在细节方面你会得到更多的回报。如果一个风湿病学家可以为超过一半的适应症开药,而胃肠病学家可以为另外几种适应症开药,销售代表就可以用更少的拜访覆盖更大的客户。“
另外,其生命周期规划还涉及开发新的配方和给药途径,这可以延长专利到期日期。2006年,AbbVie推出了Humira Pen,一种自行注射装置。
尽管最初的美国Humira专利于2016年12月到期,AbbVie正在使用其药物制造方法和配方的专利组合和新专利来获得额外的排他性年限。
“欧洲专利于2018年10月到期,为欧洲市场上的生物类似药物打开了大门,”Gilmore说。“在美国,专利排他性将持续到2023年1月21日,因此来自Amgen(Abjevita)和Samsung Bioepis(Imraldi)的Humira生物类似药物将在那时才进入这个市场。”
总结
生命周期管理对于制药公司在行业复杂和竞争激烈的环境中导航至关重要。它使公司能够最大化收入、适应市场动态、满足监管要求、增强患者获得创新疗法的机会、管理仿制药竞争并实现业务增长。
它涉及从药品最初的研发到最终退出的整个生命周期的战略规划和执行。常用的药品生命周期管理策略包括:新适应症、新配方、儿童市场排他性、疾病管理计划、战略性定价变化、授权仿制药、组合产品、下一代产品、新剂量方案、专利诉讼和处方转非处方。选择采取的策略很大程度上取决于候选药物的属性和市场评估。
*本文转载自微信公众号 - - 新药研发沧海笑
相关文件下载、服务及学习课程:
合规培训:药品注册必备知识点
委托定制:药品注册申请
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






