拒当制药界的“吃瓜群众”
CIO专家-麦冬
2019年12月新颁布实施的《中华人民共和国药品管理法》(以下简称“药品管理法”)规定,“药品监督管理部门根据监督管理的需求,可以对药品质量进行抽查检验。”而实际上,药监部门也严格履行了相应的职责,不定期开展对药品的抽查检验。
近期国家药监局发布了关于49批次药品不符合规定的通告(2023年第30号),公告中上榜的企业赫然在列,同时还对各企业进行了处罚:“要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改;国家药监局要求相关省级药品监督管理部门依据药品管理法,组织对上述企业和单位存在的涉嫌违法行为立案调查,并按规定公开查处结果。”先不谈处罚尺度是否合理,我们可先从公告中来具体分析下面两组数据。
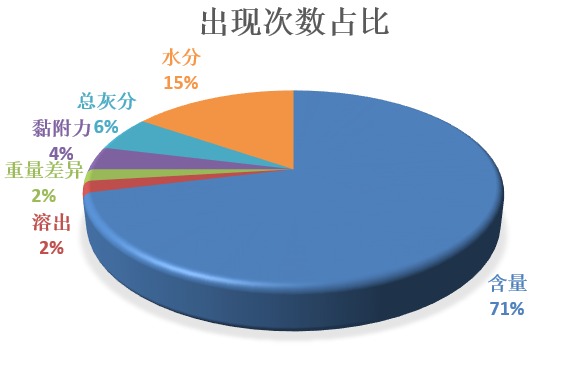
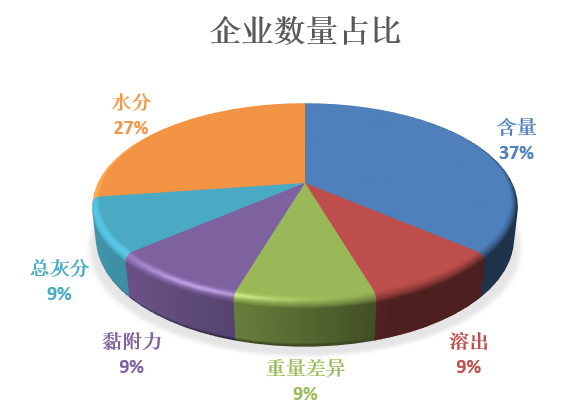
从抽检的49个批次药品中出现不同检测项目不符合规定的次数来看,含量项占所有项目的比例高达71%;即使从含量不符合规定的企业数量占比来看,16家就有4家,同样在所有项目中占比是最高的,占比37%。可见,含量检测项已然成了药品“不符合规定”的重灾区。
而含量不符合规定其实已经是踩了法律红线。药品管理法中明确将“药品成份的含量不符合国家药品标准”的情形定性为劣药;第一百一十七条还规定:“生产、销售劣药的,没收违法生产、销售的药品和违法所得,并处违法生产、销售的药品货值金额十倍以上二十倍以下的罚款;违法生产、批发的药品货值金额不足十万元的,按十万元计算,违法零售的药品货值金额不足一万元的,按一万元计算;情节严重的,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证、药品经营许可证或者医疗机构制剂许可证。”可见,国家对于生产销售劣药处罚的严厉程度可以说是史上空前的,也是下了很大的决心予以施行。
但从山东省局发布的“鲁药监处罚〔2023〕Y102号”关于山东益康药业股份有限公司的处罚金额来看,似乎与药品管理法第一百一十七条的处罚标准存在偏离。如果按十万货值金额的十倍以上二十倍以下,本次罚款金额至少应该在100-200万之间。但实际,官方通报只按货值金额的3倍算,即30万元。
从这组数据来看,不免让公众觉得困惑?为啥药监部门没有按药品管理的要求来进行处罚呢?难道药监部门对该企业存在偏袒的成分?
其实不然,我们可以从类似的劣药处罚案例中找到答案。如“湘药监药罚〔2022〕52号”对于湖南嘉恒制药有限公司的处罚,货值金额是102916元,罚款金额也按3倍算,即308748元;处罚依据是“依据《中华人民共和国药品管理法》第一百一十七条第一款、《中华人民共和国行政处罚法》第三十二条和《湖南省药品监督管理行政处罚裁量权适用规定(试行)》第八条第一款第(二)项”。再如“鲁药处罚〔2021〕Y102号”对于山东圣鲁制药有限公司的处罚,货值金额25920,处罚1300000元,即按货值10万的13倍处罚,这在药品管理法规定的罚款金额范围内;处罚依据是“依据《中华人民共和国行政处罚法》第三十二条“当事人有下列情形之一,应当从轻或者减轻行政处罚:(一)主动消除或者减轻违法行为危害后果的”、《山东省规范行政处罚裁量权办法》第十五条、《山东省市场监督管理局行使行政处罚裁量权适用规则》第十条和《山东省药品行政处罚裁量基准》的有关规定”。
从以上案例中不难看出,不同地方药监部门对于处罚的依据同样存在差异,且并不一定只单纯按药品管理法的处罚标准,更多时候还是会结合其它相关的法规,根据实际违法的严重程度与影响进行综合考评来得出最终的处罚结果。其实,也体现出地方执法部门的人性化,避免“一刀切或一棒子打死”,还是留予企业积极进行配合整改的机会,从而最大程度减少因违规带来的风险。
综上,对于药监部门判罚尺度是否合理的顾虑也就无攻自破了。但同时,我们也不免感叹,药品管理法颁布实施已近4年,为何仍然有部分企业敢于以身试法?
我认为根本原因应从法规学习、产品研究、生产/检验、体系等4个维度进行剖析,总的概括如下:
一是对于新颁布的药品管理法学习还不够深入,未能及时做好法规更新的有效培训;二是生产企业存在侥幸心理,对于药品研制阶段的考察与存在风险点考虑不够全面,产品工艺或检测方法仍然存在缺陷漏洞;三是员工在药品生产检验过程中未能严格按照注册/验证工艺/标准有效执行与监督,特别是已上市持有人委托其他生产企业生产药品的情形尤为突出;四是企业质量体系运维失控,现有体系已无法保证放行后的产品符合规定的质量标准。
那么药品生产企业的路在何方?未来应该如何规避监管的处罚?其实,羊毛终究出在羊身上,企业还需从自身存在问题的根本原因来找到答案,而不是单纯作为“吃瓜群众”对药监部门的执法尺度提出疑虑,甚至是诟病!
相关文件下载、服务及学习课程:
合规文库:中华人民共和国药品管理法
合规培训:药品管理法、刑法假劣药法规解读及药品流通假劣药现状和辨别培训
委托定制:建立持有人委托生产质量保证协议
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






