化学药品参比制剂遴选申请操作流程与注意事项
CIO专家-千里光
在化学仿制药的立项与开发过程中,参比制剂(Reference Listed Drug, RLD)占据着举足轻重的地位,是仿制药药学研究与生物等效的标杆,也是仿制药项目立项的极为关键的依据之一。按照当前的药品注册管理的相关要求,如果仿制药的上市申报缺少经药监部门确认的参比制剂,上市申请将不予受理。
截至2023年5月,国家药监部门共发布了68批次化学药品参比制剂目录,征求意见稿则公示至第69批次。对于拟开发化学药品仿制药项目的企业来说,项目调研时查询参比制剂目录,确认拟开发的药品是否已收录于参比制剂目录中,是最为基本也是必然的操作步骤之一。对于未收录于参比制剂目录中的药品,或收录的品种,其规格、持证商、生产商等信息与拟参照的药品不一致,为确保满足化学药品仿制药的立题依据,仿制药企业应当首先向国家药品审评中心(CDE)提出参比制剂遴选申请或存疑品种申请,当申请获得通过后,即申请的参比制剂被收录于参比制剂目录中,方能保障拟开发的项目具备开发的意义。
自我国启动药审改革至今,国家药监局共发布了3次关于化学仿制药参比制剂方面的公告,其中,首版公告(2016年第99号)已失效,当前执行的是《国家药监局关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)。而最新发布的《国家药监局关于发布化学仿制药参比制剂调整程序的公告》(2023年第35号),则是针对已发布的参比制剂因不再符合当前参比制剂技术要求而被撤出目录作出明确规定。
对于如何选择参比制剂,在国家局2019年第25号公告中已对遴选原则作出明确的要求,在此不再赘述,在25号公告的附件中虽然列出了申请材料目录,但当前实际执行的是CDE在2020年发布的第32号通告。现结合国家局2019年第25号公告和CDE2020年第32号通告,以“申请/推荐其他药品作为参比制剂”为例,就如何准备和提交参比制剂遴选申请以及相关注意事项进行讲解。
一、申请材料
1、资料架构
一套完整的参比制剂遴选申请材料,共有以下六大部分组成:
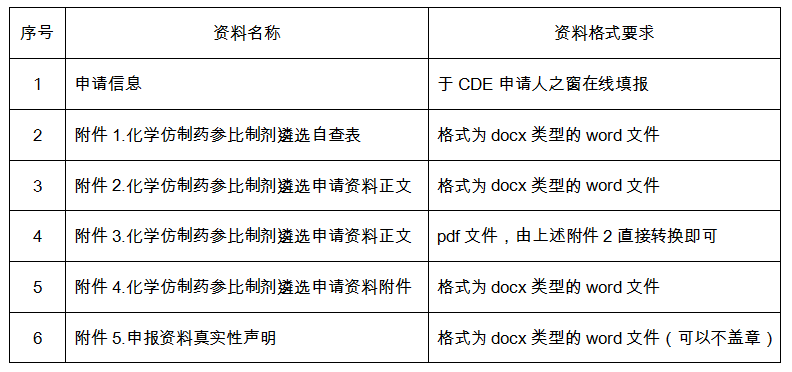
2、准备材料
2.1申请信息
需要在线填报的信息,共有三个版块,每个版块填写注意事项如下:
1)拟评价品种信息
即仿制药品的信息。对于拟开展一致性评价的品种,按照批准证明文件如实填写即可;对于尚未注册上市的品种,①批准文号:填写“无”或“/”;②批准时间:可选择2年后的任意时间;③质量标准:填写“自拟标准”;④包装材料:参照拟申请参比制剂填写。
2)申请人(推荐人)信息
如实填写申请人信息。
3)拟定参比制剂相关信息
即拟申请作为参比制剂的品种信息。对于已获批进口的药品,可通过国家药品监督管理局网站查询其注册信息;若拟定的参比制剂尚未在国内上市,则参照其在上市国获批信息进行填写,其中,批准文号和进口注册证号填写“无”或“/”。
2.2附件1.化学仿制药参比制剂遴选自查表
采用CDE2020年第32号通告中的附件模板。应当注意的是,自查表要严格按照实际情况填写;自查表填写的内容应与附件2.化学仿制药参比制剂遴选申请资料正文中的相关内容保持一致。
在自查表中,CDE对相关缺陷项设置了醒目的标识,其中,带黄色圆圈○的表示一般缺陷项,带红色星号★的表示严重缺陷项,有任何一项严重缺陷项,或3项及以上一般缺陷项,均为未通过,申请人无需考虑申请。
2.3附件2、3.化学仿制药参比制剂遴选申请资料正文
该项资料是整套申报资料中的重头文件,当中涉及多项需要调研查证的内容,调研查询的内容可作为附件4.化学仿制药参比制剂遴选申请资料附件。总体而言,需调研查证的内容主要为该品种在国内及美、欧、日主流国家与地区的获批信息、市场销售情况、质量对比、产品安全性与有效性等。
需要注意的事,CDE2020年第32号通告中所提供的正文模板中的“四、附件”与当前申报系统需提交的资料有重复,申请人可无需完全按照模板要求提交,除可及性证明文件、拟申请参比制剂说明书、审评信息需要提供外,其余证明性文件依实际情况增加;同理,正文中的各项目项下的内容,如表格,可根据实际情况灵活调整和描述。
2.4附件4.化学仿制药参比制剂遴选申请资料附件
附件4是上述附件2、3中的“四、附件”,即证明性材料,一般至少应包括以下内容:
●同品种在采购国家的上市信息:以官网查询结果为准;
●同品种在采购国家以外的地区的上市信息:以官网查询结果为准;
●同品种在采购国家的价格信息或销售情况:若为日本药品,则提供日本厚生劳动省药价目录;其余地区,可通过产品官网截图、国际知名采购平台(如亚马逊)截图、大型数据库查询结果等证明产品可及性;
●拟申请参比制剂的说明书;
●拟申请参比制剂的审评文件;
●其他在申请资料正文中提及的佐证材料。
注意事项:
1、对于上市信息较多的品种,经官网查询后,建议将文字信息复制至word文档后对格式进行优化编辑并以列表形式呈现,在保证内容清晰的前提下,尽量充分利用版面空间,同时,对拟申请参比制剂进行重点突出,如标黄处理,使整体文件达到一目了然的效果。
2、附件4是将所有附件合并的一份文件材料,且以word文档形式提供,而审评文件一般为PDF文件,因此,可以以插入对象的形式附上审评文件。文件整理完毕后,建议在其他电脑上打开文件确认对象文件是否可顺利打开。
3、为便于区分附件4中的各项证明材料,建议在每项证明材料首页的任意一角标注如:附件X.XXXXXX(附件名称)。
2.5附件5.申报资料真实性声明
参照32号通告提供的模板填写即可。由于以word文档形式上传,填写完毕即可上传,或将盖章后的扫描件以贴图形式粘贴于word文档也可。
二、提交申请
在完成上述的申请材料后,即可在线提交申请。流程如下:
①登陆申请人之窗——仿制药一致性评价——参比制剂遴选申请平台——申请/推荐其他药品作为作比制剂。如下图所示:
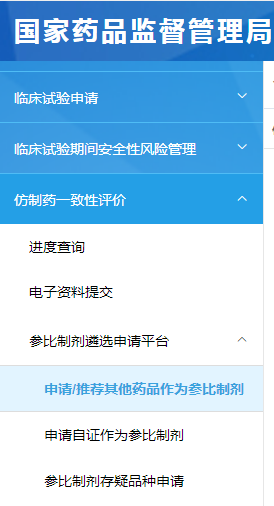
图1
②点击“新增”后,填写申请信息(上述2.1),并上传附件(上述2.2~2.5)。完成后,点击“提交”。
上述申请流程,是针对尚未发布参比制剂的情形,对于已公示申请结果,但审议未通过的品种,无论该申请是由哪家企业提出,任何企业有异议的,均可通过“参比制剂存疑品种申请”途径提出复议,详见下文3.2~3.4,两种途径对申请材料的要求完全一致。
三、申请结果
3.1申请结果公示
提交完毕后,等待CDE审核,审核时间为60个工作日。遴选申请的结果将直接在参比制剂目录征求意见稿中进行公示。公示后约1~3数日后,遴选平台中的审评状态将更新为“已公示”,申请状态见下图2:
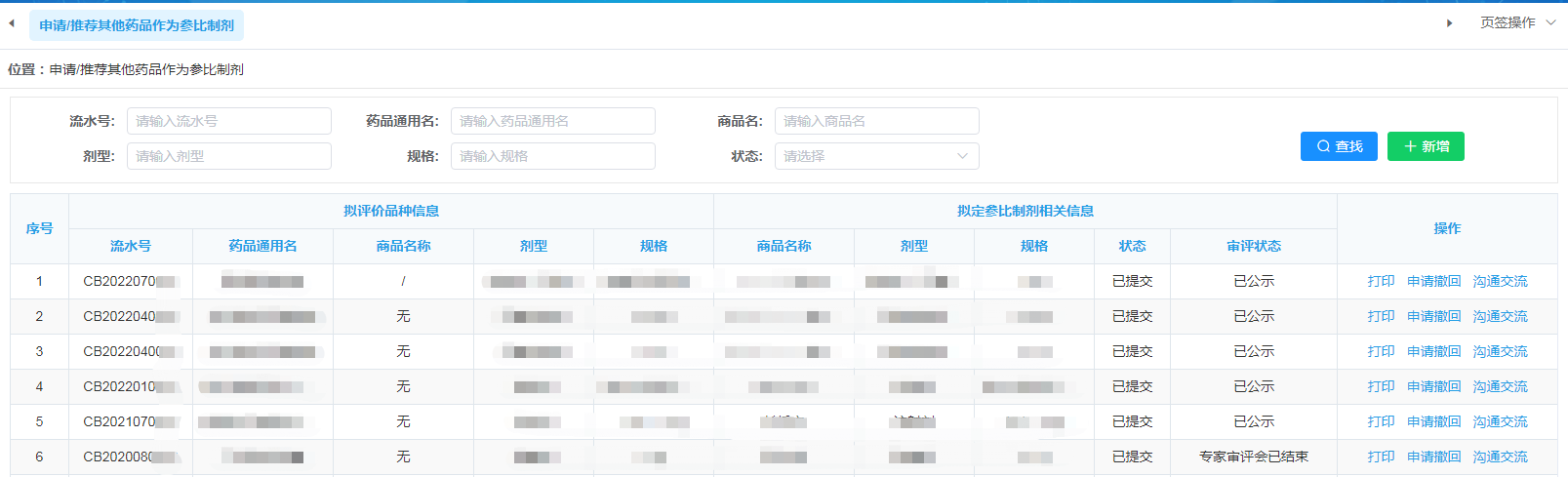
图2
3.2复议申请
对于公示结果为未通过审议,而申请人存在异议的,可在10个工作日内提出复议。提出复议的途径,即图1中的“参比制剂存疑品种申请”,具体需填写与提交的内容与首次提交遴选申请的事项完全一致,但应当注意的是,复议申请材料应当着重证明申请人拟申请参比制剂具备符合CDE要求的参比制剂地位的证据与说明,因此,应在首次遴选申请材料的基础上进行补充、调整和完善。
3.3复议审议
CDE在接收申请人的复议申请后,将于45个工作日内进行资料审核及分类处理,对符合形式要求的,CDE项目负责人将联系并告知申请人将于某个时间与评审专家开展线上讨论(答辩),并要求申请人准备答辩用PPT。PPT通过上述3.2创建的存疑品种申请列表右侧的“沟通交流”上传至系统,见下图3:
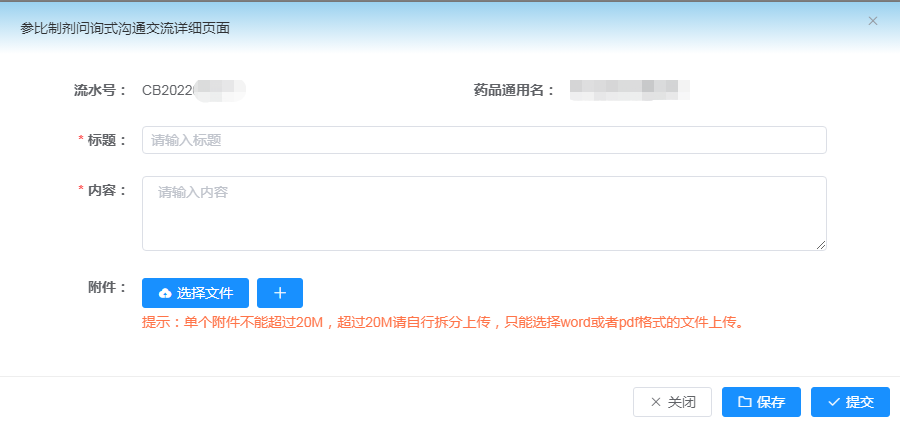
图3
注意:系统要求PPT以word文档形式上传,申请人可通过插入对象形式,将PPT插入至word中即可。上传完毕后的页面如图4所示。
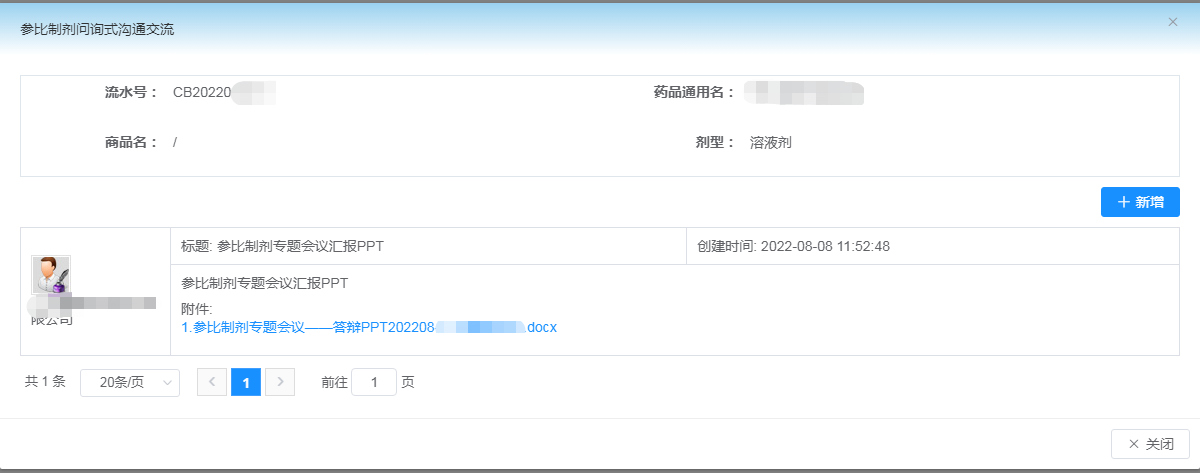
图4
3.4复议答辩
在CDE收到申请人提交的答辩材料后,将于数日后以邮件形式通知联系人具体的答辩时间,并要求安装指定的在线视频软件(小鱼易连)。
参与审议的专家除CDE内部专家外,还有其他外聘专家。整个答辩时长不超过15分钟,当中包含互动讨论前申请人对项目的5分钟简要陈述,由于陈述时间短,对于PPT内容较多的,不要全部照读,陈述时应当精炼且重点突出,建议演讲者在答辩前多次练习,保障陈述过程清晰流畅。
根据笔者的经验,参与答辩的专家在申请人陈述完毕后,将直接围绕自查表中被标识的缺陷项发问,当出现任意一项严重缺陷项,则答辩直接宣告结束。因此,申请人在准备复议申请材料时,可以通过评估拟申请参比制剂最可能被专家认为不符合参比制剂地位的事项补充更多的支持性材料。
答辩结束后,在申请人之窗中的申请列表可见,审评状态更新为“专家审评会已结束”(见图2)。
四、总结
参比制剂遴选申请的操作过程较为简单,但申请材料的准备并不简单,尤其是对于原研不明确的品种,更应围绕如何证明具有“国际公认地位”来收集证明性材料。另外,参照自查表,当出现严重缺陷项或3个及以上一般缺陷项时,申请人可直接中止该次遴选申请。申请人通过准备参比制剂遴选申请材料,也是对仿制药项目立题合理性的一次验证与审核过程。
相关文件下载、服务及学习课程:
合规文库:国家药监局关于发布化学仿制药参比制剂调整程序的公告(2023年第35号)
委托定制:仿制药上市许可申请
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






