干细胞治疗产品,从实验室到上市还有多远?
CIO专家-元参
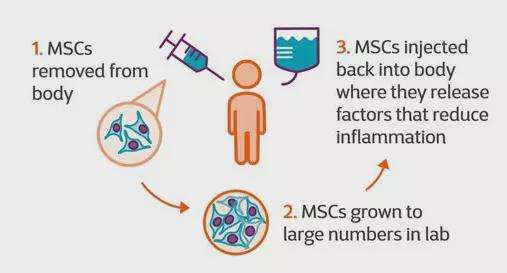
在人的身体里有一种神奇的细胞,叫做干细胞。这些干细胞具有多样的潜能,可以变成我们身体里的各种细胞,来替换身体里损坏了的或是生病了的细胞,就像是人身体里的修理工具包。
我国干细胞产业发展现状
经过多年发展,中国干细胞行业具备了一定的产业基础。从上游的干细胞存储,中游的细胞药物研发到下游的干细胞临床转化应用,目前已形成了相对完整的干细胞产业链。处于产业链上游的主要是干细胞采集与存储企业,比如脐带血库、造血干细胞库、中源协和、北科生物等;干细胞产业链中游是干细胞增殖与药物研发企业,比如冠昊生物、九州集团、中航生物等;产业链下游是指由开展干细胞临床研究转化应用的机构组成,主要是医院。

干细胞在再生医学领域所具有的不可估量的医学价值和巨大的商业价值。2020-2026年,中国干细胞产业市场规模复合增长率约为15%,未来几年,中国干细胞产业市场规模在全球市场规模中的占比将进一步上涨。前瞻保守估计,到2026年,中国干细胞产业市场规模将达到325亿元。
干细胞从实验室到上市还有多远?
一个新药从立项到最后的上市往往要经历基础研究、新药发现、临床前研究,临床研究(就是上面提到的Ⅰ期、Ⅱ期、Ⅲ期临床试验),最后才能进入上市与流通阶段,即便上市了,还要经过再评价这个门槛才行。这个过程投入高、周期长、艰难险阻多是众所周知的。
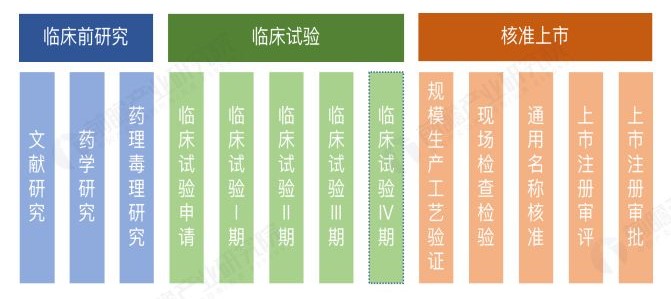
为鼓励新药研发和提高新药审批效率,我国开启了新药临床默认审批制度,新药临床试验也由过去的审批制度转变为默示许可制。
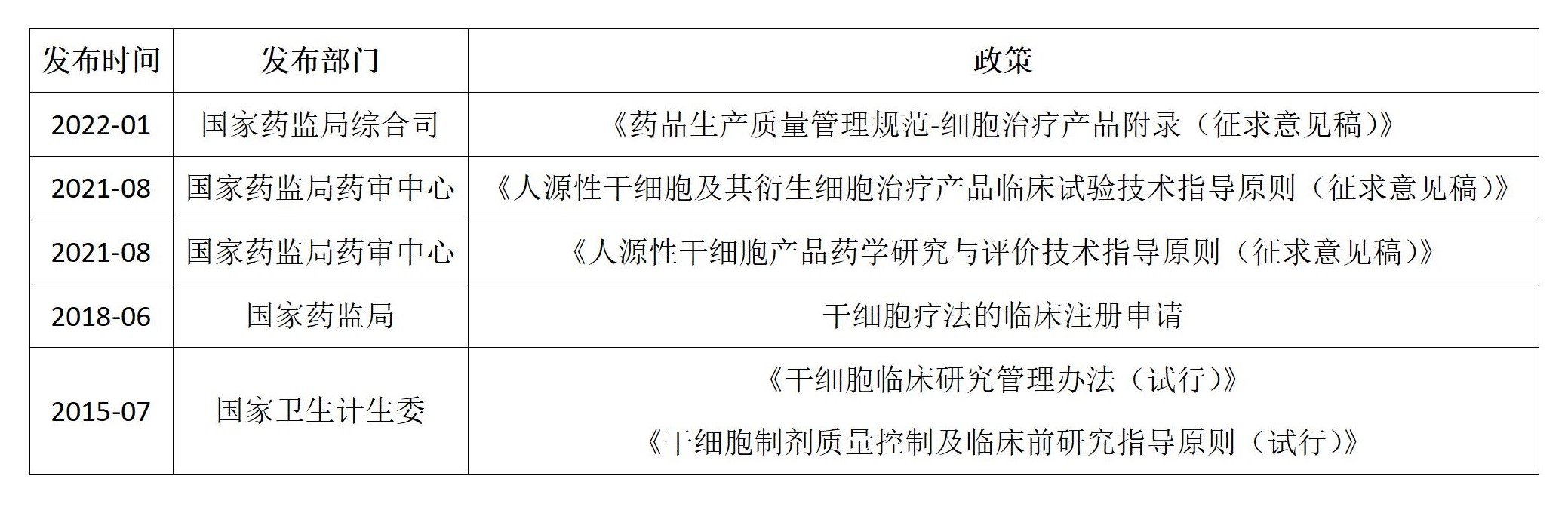
在干细胞临床应用方面,根据国家药品监督管理局药品审评中心(CDE)公示信息显示,截止2022年1月5日,干细胞临床研究备案项目达到111个,干细胞临床研究备案机构133家(含军队医院),共有23个干细胞新药项目获得国家临床默示许可。分别是胎盘、脐带、骨髓、牙髓、宫血、异体/自体脂肪来源的间充质干细胞,适应证包括了膝骨关节炎、类风湿关节炎、糖尿病足溃疡、肺纤维化、肝衰竭、卒中、急性呼吸窘迫综合征、牙周炎、克罗恩病和GvHD等。
未来,中国干细胞产业的发展将主要体现在三个方面。间充质干细胞是再生医学中最常用的干细胞类型,当前有大量的间充质干细胞临床试验在全球范围内展开,随着研究进程的加快,将推动间充质干细胞产品的临床转化进程;此外,干细胞技术的应用范围也将随着研究的深化而得到拓展。
干细胞获得药证的前提是GMP
干细胞产品上市需要获得临床试验批件和药品注册证,这要求干细胞在研发和生产过程中符合GMP标准,达到法规可控制的细胞制备过程,和法规(药证)允许使用的细胞产品。
2022年1月6日,国家药监局综合司公开征求《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》意见,强调质量与特性的均一性,在生产管理方面指出无菌工艺、验证最差及防污控制。
(1)细胞产品、直接用于细胞产品生产的基因修饰载体或其他起始生物材料均应进行无菌工艺模拟试验。
(2)验证最差条件,不仅包含工艺最差条件,同时厂房如同一生产区域有多条相同生产线的,最多可同时进行生产操作的生产线数量也应当考虑。
(3)生产中污染和交叉污染的防控需充分考虑了细胞产品本身的特殊性,结合风险管理和目前的生产现状,细胞培养和生产划分为两个相对独立的阶段进行管理。
由此可见,国家对产品提出了更高的管理要求,对于细胞治疗的小企业,需要提早布局,早期搭建全生命周期质量体系(GMP),做好细胞治疗产品的质量控制。
CIO合规保证组织提供干细胞制备的GMP车间咨询。车间建设严格遵循了制药行业的质量管理规范——GMP标准,引入了无菌隔离器、自动化细胞培养设备以及自动化深低温细胞存储系统等一系列先进的设备设施,囊括了干细胞分离、制备、存储及制剂生产等自动化、封闭式细胞制造工艺的多个环节,满足了干细胞制备、存储以及大规模干细胞制剂生产阶段的不同需求,为打造最具专业性、时效性、高品质的干细胞制备及存储平台提供了有力保障。
相关文件下载、服务及学习课程:
合规文库:药品生产质量管理规范-细胞治疗产品附录(征求意见稿)
合规培训:限免-药品生产现场管理培训
合规服务:细胞治疗产品GMP咨询服务
联系专家,获取专家指导意见:e邀专家
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






