无源医疗器械原材料变更后,如何对其进行评价?
CIO专家-山丹
原材料是医疗器械产品实现其预期功能的重要载体,也是其安全性和有效性的重要保障,使得医疗器械原材料变化的变更控制在各项变更事项中显得尤为重要。因此,当生产产品所用的原材料发生变化时,注册人应充分评估原材料变化对最终医疗器械产品可能带来的影响,以将变化引起的风险降低至可接受范围,并根据法规要求评估是否需要进行注册审批。
一般来说,原材料变化可能对医疗器械的产品性能、生物相容性、生物安全性、灭菌/消毒效果及残留、有效期等产生影响。实验室研究、生物学评价或临床评价等均是验证风险控制措施有效性的手段。那么具体都涉及到哪些方面呢?我们一起来看看。
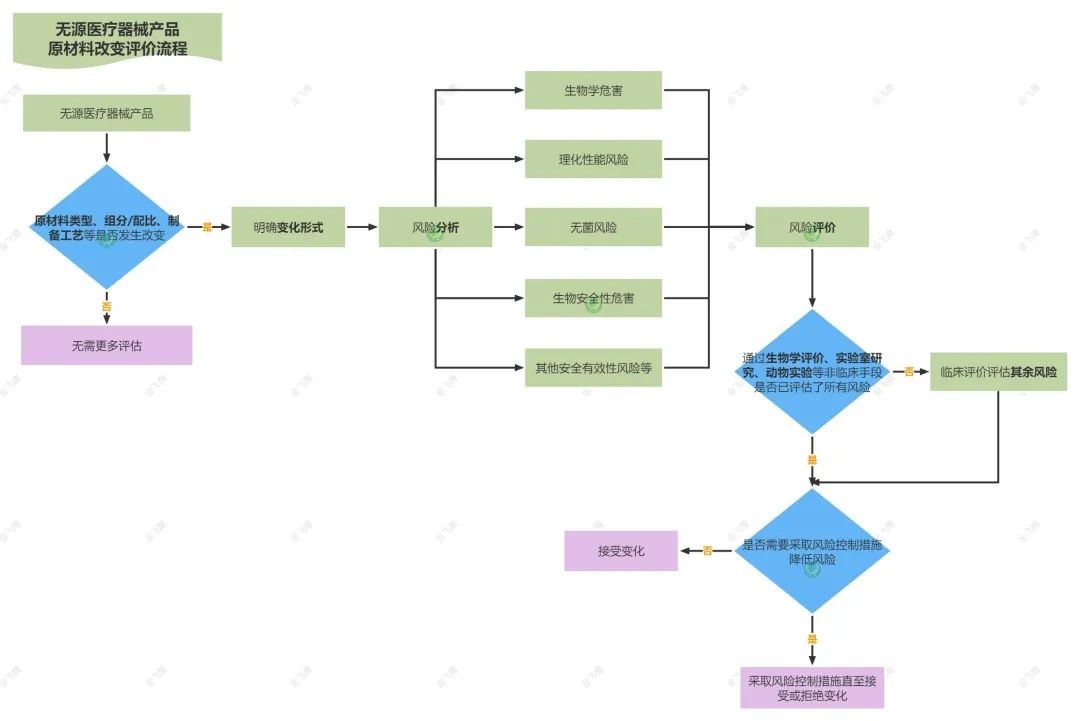
1. 判断材料变化形式
首先,注册人应首先判断产品原材料是否发生变化。一般来说,产品原材料发生改变一般包括以下几种情形:
一是原材料类型的改变,如管路类材料由聚氯乙烯变成聚氨酯等;
二是材料组分和/或配比发生改变,如聚氯乙烯材料中增塑剂、抗氧化剂的成分和/或比例改变,虽然材料类型仍为聚氯乙烯,但材料的性能已经完全不同;
三是材料制备工艺的改变,比如某些橡胶材料的硫化工艺、金属材料的锻造工艺、透明质酸钠的提纯方法等的改变。
除此之外,还会存在其他可能涉及前述类型的改变,如原材料制造商、牌号等的变化。
2. 生物学评价
一般来说,注册人应首先判断变化材料是否与人体发生直接或间接接触。
其次,注册人应对任何材料变化进行评估以判断是否引发任何新的生物学危害。风险评估过程中应根据材料变化的类型、材料在器械中发挥的作用等特点,并充分考虑申报器械的临床应用、接触时间、接触性质等进行,某些情况下还应考虑因材料变化造成的某些物理特性(几何构造、颗粒等)改变,进而带来的潜在生物相容性风险。
3. 实验室研究
医疗器械原材料变化除通过生物学评价评估其可能的生物学危害之外,还宜对照产品安全有效性清单要求、设计开发程序等文件,通过实验室研究评估变化对产品性能、灭菌、有效期等的影响。
首先,注册人应考虑原材料改变是否影响相关组件或最终产品的理化性能、使用性能等。
其次,还应参考安全有效性清单、设计开发程序要求等文件规定,考虑前述性能风险之外的其他风险,比如消毒/灭菌效果及残留、有效期等均应在考虑范围之内。
4. 动物实验及临床评价
当生物学评价和实验室研究结束后,应评价其风险是否可接受。只有当前述研究不足时,才考虑通过动物实验开展进一步的验证,具体原则和要求可参考医疗器械动物实验研究相关技术审查指导原则。
而某些材料的改变可能产生临床的影响,这种影响又无法通过前述实验室研究和/或生物相容性和/或动物实验评价进行充分评价时,则应考虑进行临床评价。
5. 风险评价及控制
需要说明的是,当风险评价认为存在风险时,应根据YY /T 0316《医疗器械风险管理对医疗器械的应用》等标准要求继续通过风险控制措施、风险受益分析等手段进行评价,直至拒绝变化或降低风险至可接受水平。
最后附上无源医疗器械产品原材料改变评价流程图,大家记得收藏备用。
*本文来源 - - 器械早班车微信公众号
相关文件下载、服务及学习课程:
合规文库:医疗器械注册管理办法
委托定制:医疗器械注册证 变更注册
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点。本文为转载文章,版权归原作者所有,如涉侵权,请联系我们删除。

























