一文读懂新政下药品生产监督检查后处置工作流程
CIO专家-山丹
随着社会的发展和人民健康意识的提高,药品安全问题越来越受到公众的关注。为了保障药品生产的质量与安全,近期,笔者从山东省药品监督管理局官网检索到,由山东省药品监督管理局组织起草的《山东省药品监督管理局药品生产监督检查后处置工作程序》正在征求意见,会稿截止日期2024年6月28日。该工作程序根据为加强药品生产日常监督管理,规范药品生产监督检查后处置工作,确保药品安全、有效、质量可控,保障公众用药安全和合法权益。根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《药品生产监督管理办法》和《药品检查管理办法》(试行)等有关法律、法规、规章、标准和规范,结合山东省实际而制定,该新规对其他省份具有参考价值。
一、药品生产监督检查后实施多项风险控制措施确保用药安全
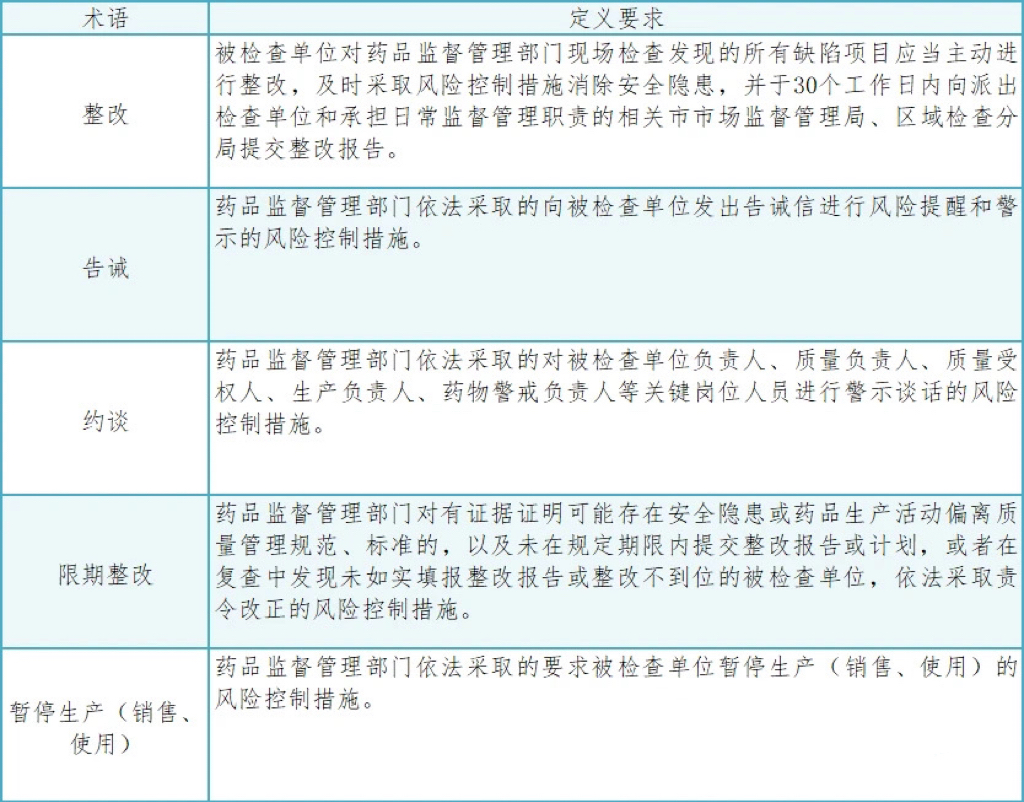
药品生产监督检查后实施的一系列风险控制措施包括整改、告诫、约谈、限期整改、暂停生产(销售、使用)以等,旨在确保药品生产符合相关法律法规和标准,保障公众用药安全。通过实施一系列风险控制措施,能够及时发现和消除药品生产中的安全隐患,提高药品生产质量,保障公众用药安全。相关术语及其定义梳理如下:
二、最新药品生产监督检查后处置工作流程关注点
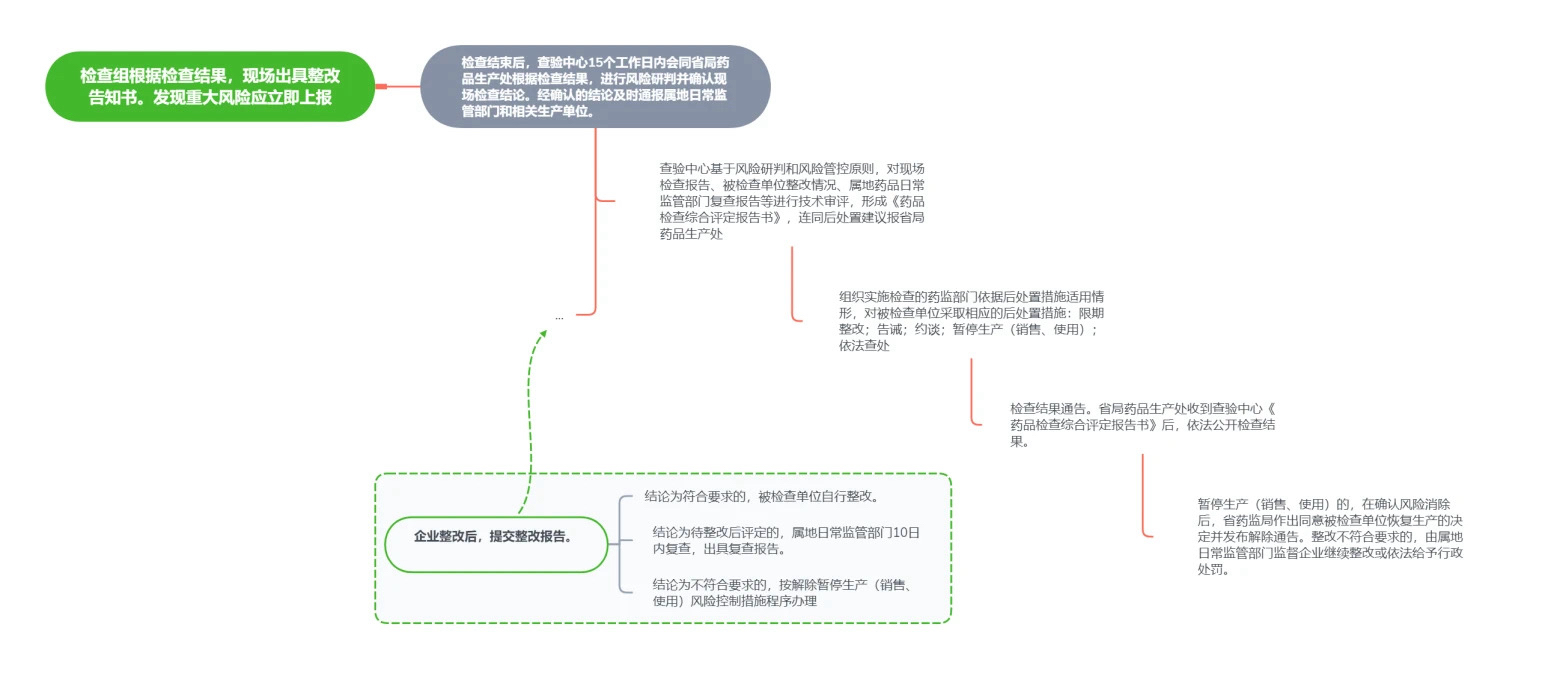
1、药品生产监督检查后处置工作流程图
药品生产监督检查后处置工作流程图如下:
2、现场检查结论的评定标准有哪些?
| 类型 | 评定标准 |
| 符合要求 | 未发现缺陷或缺陷质量风险轻微、质量管理体系比较健全的。 |
| 待整改后评定 | 发现缺陷有一定质量风险,但质量管理体系基本健全,包含但不限于以下情形: (1)与药品GMP要求有偏离,可能给产品质量带来一定风险; (2)存在主要缺陷或多项关联一般缺陷,经综合分析表明质量管理体系中某一系统不完善。 |
| 不符合要求 | 发现缺陷为严重质量风险,质量体系不能有效运行,包含但不限于以下情形: (1)对使用者造成危害或存在健康风险; (2)与药品GMP要求有严重偏离,给产品质量带来严重风险; (3)编造生产、检验记录,药品生产过程控制、质量控制的记录和数据不真实; (4)存在严重缺陷或多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行; (5)涉嫌违反《药品管理法》《药品生产监督管理办法》等法律法规规学,需要立案查处的; |
3、后处置流程
| 项目 | 关注点 |
| 检查报告审核 | 为确保药品生产安全,现场检查后检查组立即通知被查单位整改缺陷并建议风险控制措施,同时将报告和资料报送省食药审评查验中心。中心在15个工作日内进行风险研判和会商,确认检查结论并形成审核意见,必要时有权调整缺陷类型或结论。 |
| 风险通报 | 确认检查结论后通报监管部门,调整结论通知被查单位,提出处置措施,待整改后复查,视情况采取风控措施。 |
| 企业整改 | 被查单位需整改缺陷项目,并报告给监管部门,30日内提交整改报告。审核后需调整的,可延长10日整改期。无法按期完成的,需制定整改计划并补充报告。整改期间需采取风险控制措施,整改报告应当至少包含缺陷描述、缺陷调查分析、风险评估、风险控制、整改审核、整改效果评价等内容,针对缺陷成因及风险评估情况,逐项描述风险控制措施及实施结果。 |
| 整改复查 | 符合要求的,监管部门在下次检查时复查整改情况;待整改评定的,10日内现场复查并报告,报省食药审评查验中心审核;不符合要求的,按解除暂停生产等风险控制措施程序办理整改复查。 |
| 综合评定 | 省食药审评查验中心根据风险研判和管控原则,出具《药品检查综合评定报告书》报药品生产处。结论符合或不符合的,10日内完成;待整改后评定的,20日内完成技术审核,提出后处置措施建议。 |
| 采取后处置措施 | 包括整改、告诫、约谈、限期整改、暂停生产(销售、使用)等。 |
| 检查结果通告 | 药品生产处负责信息公开,收到《药品检查综合评定报告书》后,通过公文系统、网站发布结果,并为符合要求的单位出具《药品GMP符合性检查告知书》,确保公众及时获取药品生产检查结果。 |
| 解除暂停生产(销售、使用)风险控制措施 | 被检查单位整改后向监管部门申请解除风险控制,并提交报告。监管部门复查后报药品生产处,组织技术审查,必要时再次检查。符合要求则出具审查意见,经省药监局批准后下达解除通知,并发布通告。不符合要求则继续整改或处罚。 |
*本文来源 - - 智药公会微信公众号
相关文件下载、服务及学习课程:
合规文库:药品生产质量管理规范(2010年修订)
合规培训:药品GMP自检法规及要点解析
委托定制:GMP合规审计(符合性检查)
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点。本文为转载文章,版权归原作者所有,如涉侵权,请联系我们删除。
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






