基本信息
1、办理部门:北京市药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:
北京市政务服务中心——北京市丰台区西三环南路1号(六里桥西南角)(1-3层综合窗口)
北京城市副中心政务服务中心——北京市通州区新华东街48号二区(东南角)(综合窗口)
4、咨询电话: (010)89150290 CIO咨询:400-003-0818
受理条件
一、申报资料应当有所提交资料目录,包括申报资料的一级和二级标题。每项二级标题对应的资料应当单独编制页码。 二、申报资料应当按目录顺序排列并装订,其中质量管理体系文件部分应当单独成册。 三、申报资料一式一份,应当使用A4规格纸张打印,内容完整、清楚,不得涂改,政府部门及其他机构出具的文件按照原件尺寸提供。 四、申报资料使用复印件的,复印件应当清晰并与原件一致。 五、各项申报资料中的申请内容应当具有一致性。 六、各项文件除关联文件外,均应当以中文形式提供,如证明性文件为外文形式,还应当提供中文译本。根据外文资料翻译的申报资料,应当同时提供原文。
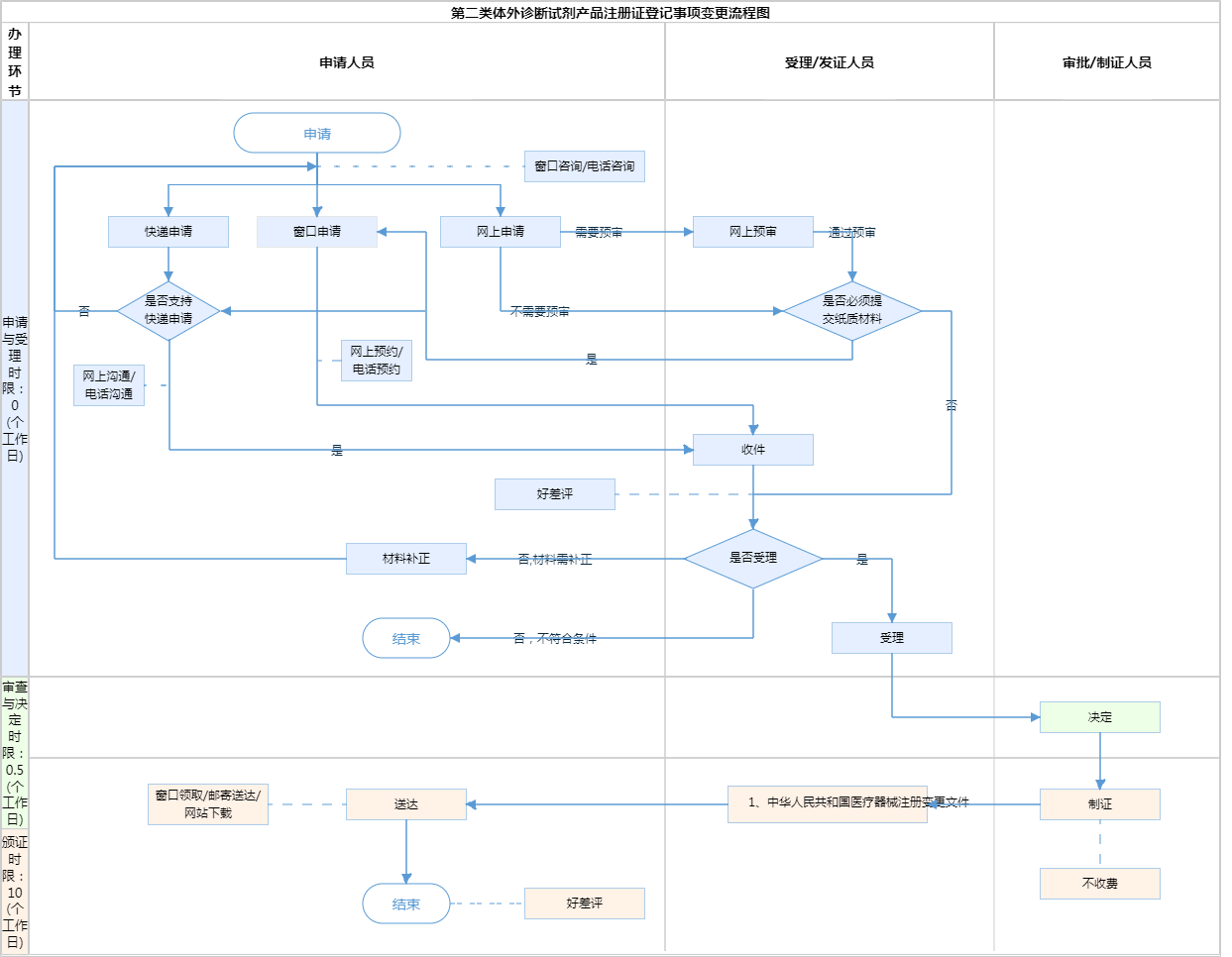
办理流程
流程文字说明
1、受理(时限:0个工作日)
办理结果:符合要求的,作出行政许可决定;不符合要求的,作出不予行政许可决定。
2、决定(时限:0.5个工作日)
办理结果:符合标准的,同意。
3、发证(时限:10个工作日)
办理结果:中华人民共和国医疗器械注册变更文件。
申请材料
1、北京市依申请政务服务事项告知承诺书;
2、第二类体外诊断试剂产品变更备案申请表;>>申请表
3、注册人企业营业执照(副本)或事业单位法人证书(副本);
4、原医疗器械注册证书及其附件;
5、历次医疗器械变更注册(备案)文件及其附件;
6、符合性声明;
7、注册人关于变更情况的说明;
8、其他文件;
9、授权委托书。
结果样本

常见问题
问题1:医疗器械产品注册证有效期?
答:5年。
本办事指南摘自药监局官网,如有变动,以官方发布为准。