基本信息
1. 办理部门:浙江省药品监督管理局
2. 办理方式:网上申请
3. 办理地点:企业所在地药品监督管理部门
4. CIO咨询:400-003-0818
受理条件
医疗器械注册人、备案人、受托生产企业。
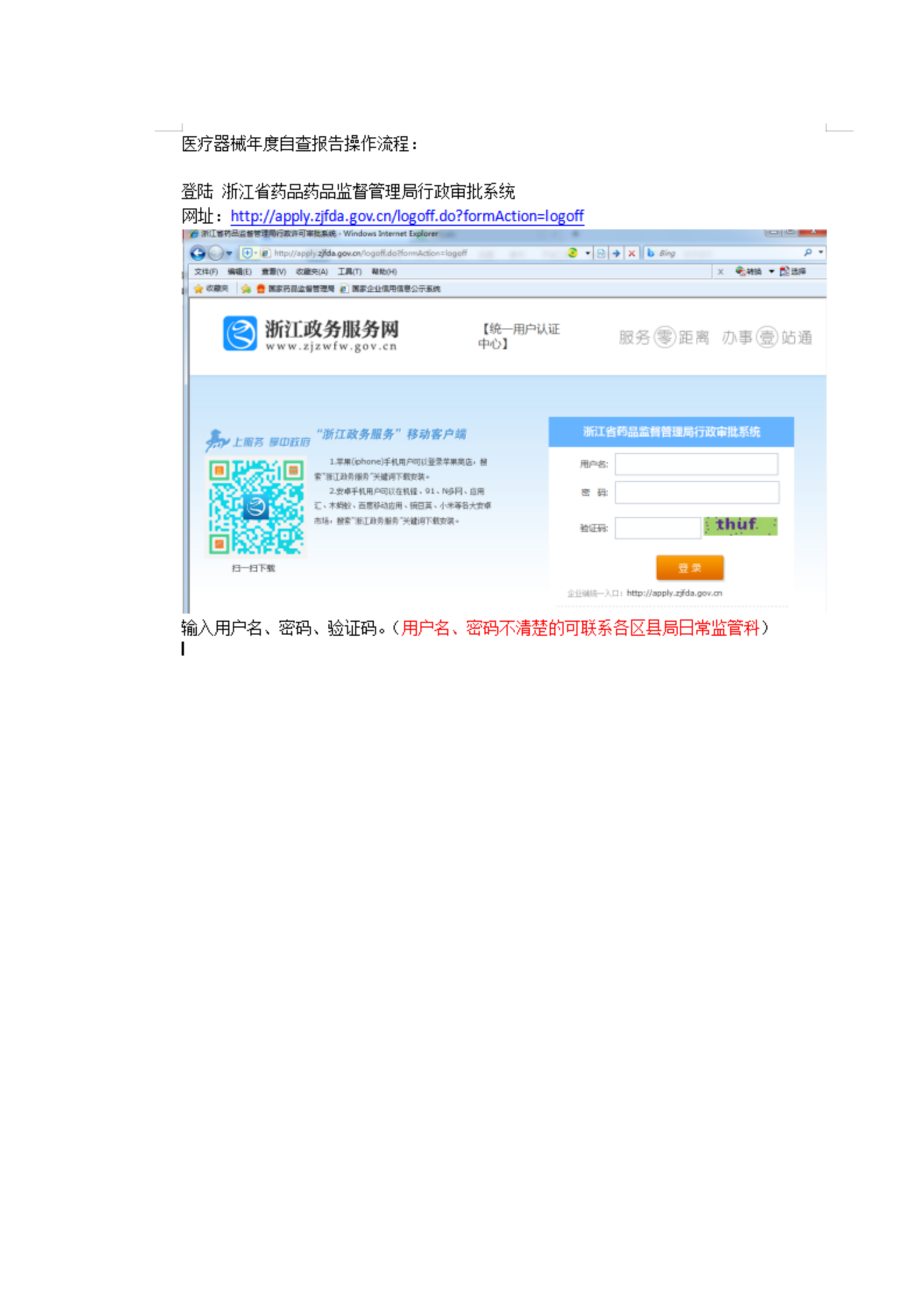
办理流程
流程文字说明
次年3月31日前登录浙江省药品监督管理局器械生产信用管理系统点击质量管理体系自查报告线上填报。
常见问题
问题1:医疗器械生产企业质量管理体系年度自查报告什么时候提交?
答:第四十五条 医疗器械注册人、备案人、受托生产企业应当每年对质量管理体系的运行情况进行自查,并于次年3月31日前向所在地药品监督管理部门提交自查报告。进口医疗器械注册人、备案人由其代理人向代理人所在地省、自治区、直辖市药品监督管理部门提交自查报告。
本办事指南摘自药监局官网,如有变动,以官方发布为准。