基本信息
1、办理部门:安徽省药品监督管理局
2、办理方式:网上办理、窗口办理
3、办理地点:安徽省合肥市包河区马鞍山路509号安徽省政务服务中心1号办事大厅企业开办综合窗口
4、咨询电话:0551-62999869、0551-62999793 CIO咨询:400-003-0818
受理条件
第二类医疗器械(不含体外诊断试剂)注册证及附件载明的产品名称、型号规格、结构及组成、适用范围、产品技术要求等内容发生变化的。
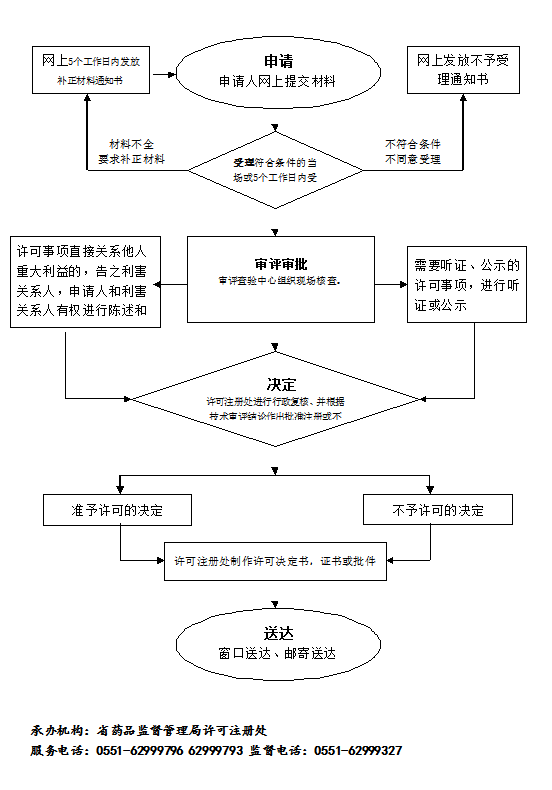
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:7个工作日
1、受理(时限:1个工作日)
2、收费(时限:0个工作日)
3、审查(时限:5个工作日)
4、决定(时限:1个工作日)
5、办结(时限:0个工作日)
申请材料
结果样本

常见问题
问题1:哪几个方面的变更属于第二类医疗器械产品变更注册?
答:已注册的第二类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;注册证载明的产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械的生产地址等,属于需要办理变更注册的事项。
问题2:医疗器械注册证有效期内有新的医疗器械强制性标准和/或国家标准品发布实施,是否需要办理变更注册?
答:如医疗器械注册证有效期内有新的医疗器械强制性标准和/或国家标准品发布实施,已注册产品为符合新的强制性标准和/或国家标准品所做的变化属于应当办理变更注册的,注册人应当提交申请延续注册前已获得原审批部门批准的变更注册(备案)文件及其附件的复印件。 已注册产品为符合新的强制性标准和/或国家标准品所做的变化属于无需办理变更注册手续或者无需变化即可符合新的强制性标准和/或国家标准品的,注册人应当提供情况说明和相关证明资料。
问题3:自检需要符合哪些要求?
答:注册申请人注册时开展自检的,申请人应当具备自检能力,并将自检工作纳入医疗器械质量管理体系,配备与产品检验要求相适应的检验设备设施,具有相应质量检验部门或者专职检验人员,严格检验过程控制,确保检验结果真实、准确、完整和可追溯,并对自检报告的真实性依法承担责任。 申报资料应当符合国家药监局《关于发布〈医疗器械注册自检管理规定〉的公告(2021年第126号)》的要求。
本办事指南摘自药监局官网,如有变动,以官方发布为准。

























