基本信息
1、办理部门:安徽省药品监督管理局
2、办理方式:网上办理、窗口办理
3、办理地点:安徽省合肥市包河区马鞍山路509号安徽省政务服务中心1号办事大厅企业开办综合窗口
4、咨询电话:0551-62999793、0551-62999796 CIO咨询:400-003-0818
受理条件
1. 申报产品已确定为第二类体外诊断试剂,注册申请人为安徽省省内企业;
2. 按照有关规定取得企业营业执照和组织机构代码证;
3. 已具备拟注册产品的生产能力;已按照已按照《体外诊断试剂质量管理体系考核实施规定(试行)》、《体外诊断试剂生产实施细则(试行)》的要求建立医疗器械生产质量管理体系;
4. 已编制完成拟申请产品的体外诊断试剂产品技术要求,完成检验且结论为合格;
5. 已完成对临床评价资料的汇总和分析;
6. 已参照执行国家药品监督管理局已发布的相应技术指导原则;
7. 办理医疗器械注册申请的人员具有相应的专业知识,熟悉医疗器械注册管理的法规、规章和有关的技术要求。
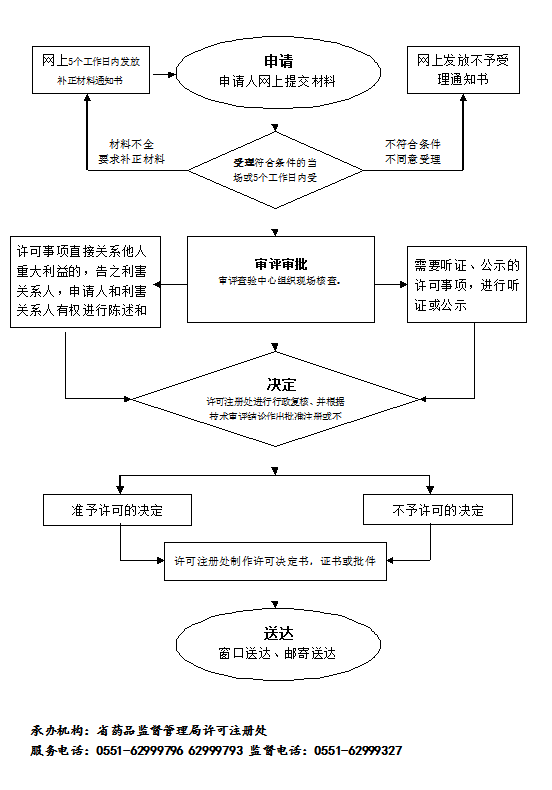
办理流程
流程文字说明
法定办理时限:20个工作日;承诺办理时限:10个工作日
1、受理(时限:1个工作日)
2、收费(时限:0个工作日)
3、审查(时限:8个工作日)
4、决定(时限:1个工作日)
5、办结(时限:0个工作日)
申请材料
1、监管信息;
2、综述资料;
3、非临床资料;
4、临床评价资料;
5、说明书标签样稿;
6、质量管理体系文件。
结果样本

常见问题
问题1:“申请人”、“申请人住所”是填企业名称和地址还是法人代表的名称和住所?
答:“申请人(企业名称)”、“申请人住所”与工商营业执照中相应内容一致。
问题2:企业在申请注册申报或者补充检验时是否一定要提交注册检验报告?
答:医疗器械注册申请资料中的检验报告,应当执行《医疗器械监督管理条例》要求。产品检验报告应当符合国务院药品监督管理部门的要求,可以是医疗器械注册申请人、备案人的自检报告,也可以是委托有资质的医疗器械检验机构出具的检验报告。
问题3:小微企业优先审批第二类医疗器械产品免除首次注册费相关解释?
答:一、优先审批的第二类医疗器械产品是指符合《关于发布安徽省第二类医疗器械优先审批办法(试行)的通告》(〔2021〕年第19号)要求的产品。二、参照原国家食品药品监督管理总局制定的《医疗器械产品注册收费实施细则》中的相关规定,对符合《中小企业划型标准规定》(工信部联企业[2011]300号)条件的注册申请人,申请小微企业优先审批产品免除首次注册费需提交以下材料:1.小型微型企业收费优惠申请表(表格见申报材料“第二类体外诊断试剂注册申请表”项目栏);2.企业的营业执照副本(实现信息共享以后可通过网络核验,无需申请人提供);3.上一年度企业所得税纳税申报表或统计部门出具的上一年度有效统计表,但营业执照范围仅为医疗器械生产的新开办医疗器械生产企业除外;4.安徽省药品监督管理局出具的优先医疗器械审查通知单。纸质资料提交或邮寄至马鞍山路509号省政务大厦C座214。
本办事指南摘自药监局官网,如有变动,以官方发布为准。

























