原因何在?从临床开发视角浅谈某生物股票大跌
CIO专家-山丹
今天的生物制药圈被硕迪生物股票大跌43%及其口服GLP-1小分子GSBR-1290的信息刷屏。该分子的Ib/IIa期虽然达到了首要终点,但作为后来者,治疗12周,A1c下降~1%,体重下降~3.5%,与礼来的Orforglipron非头对头相比,疗效较弱,导致股票大跌。原因何在?这里抛开分子结构,从早期临床开发的角度分析这个问题。
硕迪GLP-1小分子的早期临床开发
从clinicaltrial.gov上只看到GSBR-1290的3项研究:
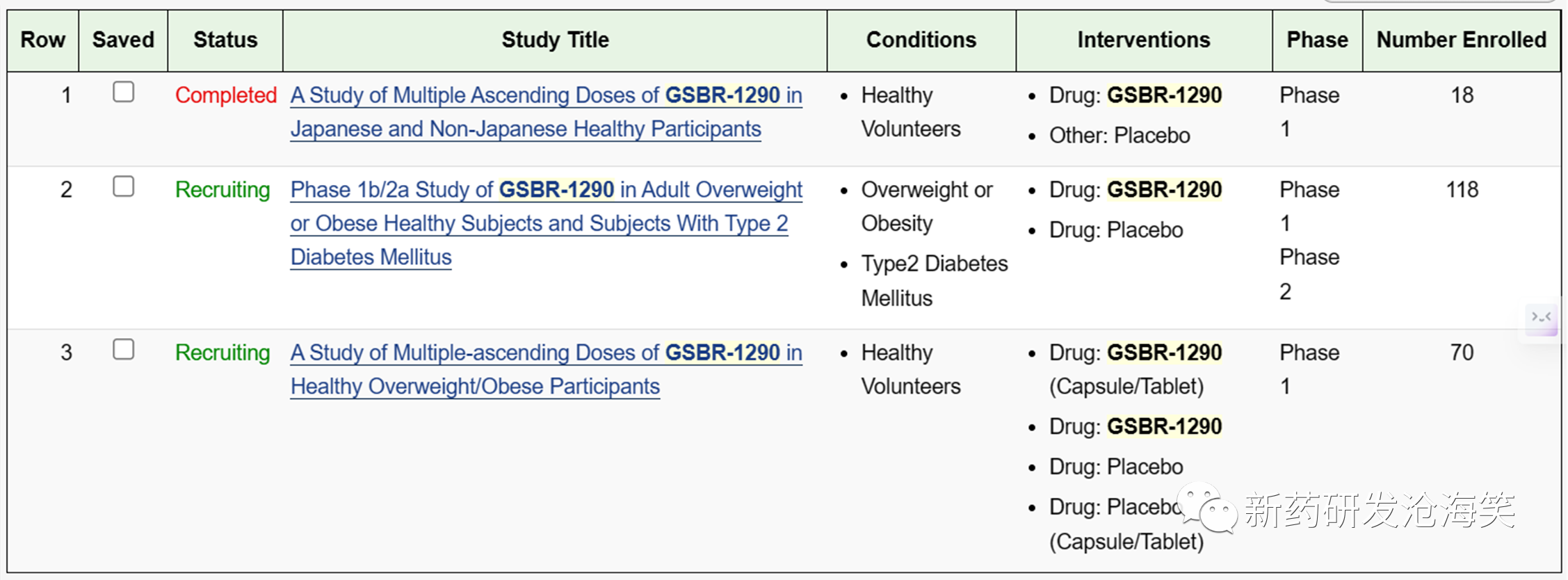
1)1项日本人及非日本人(高加索或非裔)健康受试者的多剂量爬坡(MAD)的I期研究,样本量为18,采用交叉设计;2)1项在超重肥胖健康受试者,样本量为70;探索两种剂型(胶囊及片剂),还探索3种给药方案。3)1项目在超重肥胖健康受试者以及2型糖尿病受试者的Ib/IIa期临床研究,样本量为118。糖尿病受试者有2种给药方案,超重肥胖受试者中只有1种给药方案。见下图。
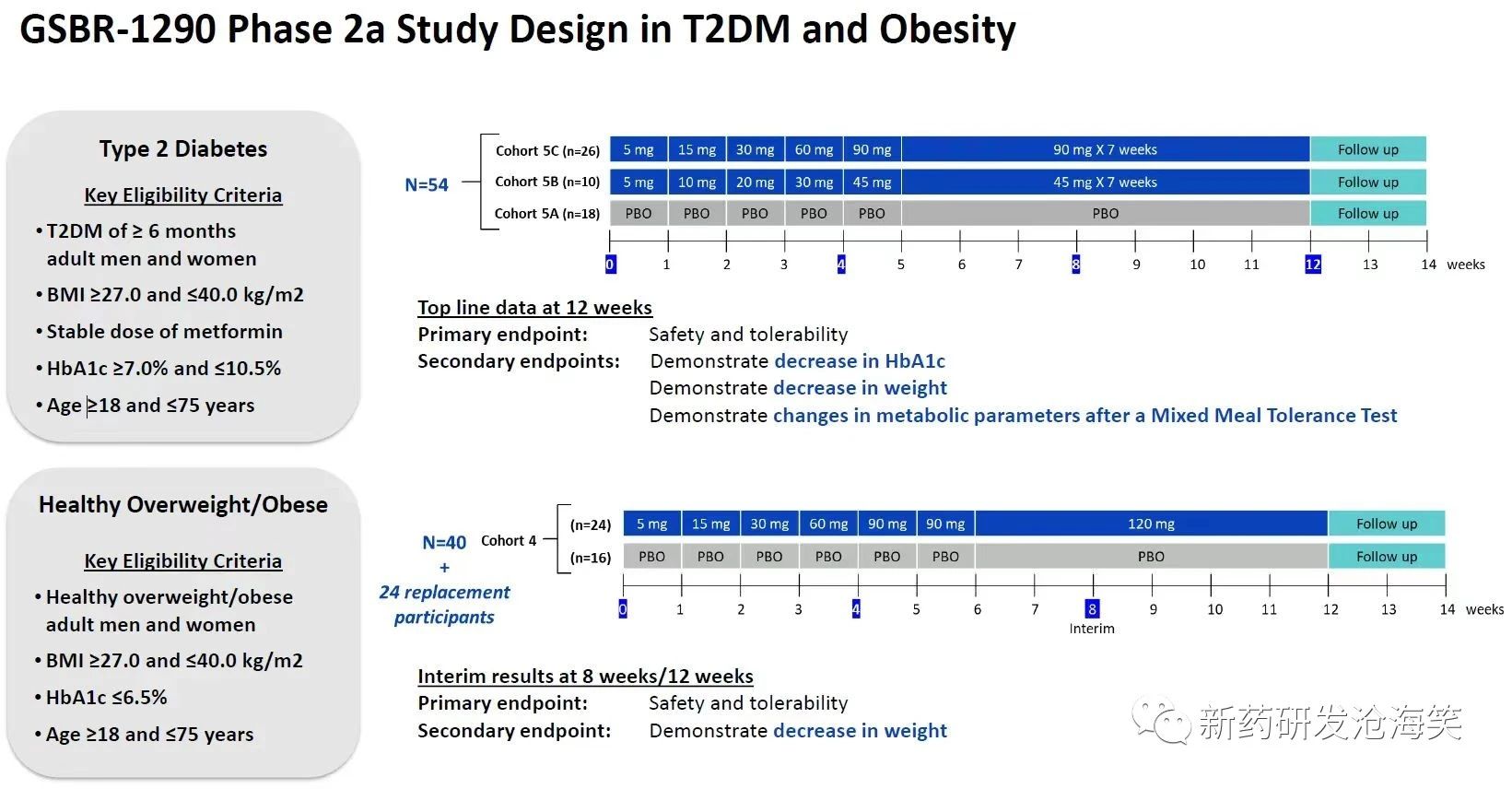
这个分子在的临床开发,特点很明显:1)成本很低,并且企图达成多个研究目的。比如,很少的样本量,交叉设计,但却入组多种种族人群,不同的患者人群,还比较胶囊及片剂在特征。2)剂量没有探索。糖尿病45mg和90mg, 以及超重肥胖的120mg给药方案的依据是什么?早期研究应该看到更多的剂量探索,但这里却像III期一样了,只有1或2个剂量。3)SAD研究呢?今天在股价大跌,或许也跟这个分子在早期临床开发不够稳健,剂量探索不够充足有关。
礼来GLP-1小分子的早期临床开发
再来看看礼来GLP-1小分子的I期临床研究设计。进II期前,开展了5个I期研究,有健康人的SAD研究,超重肥胖的I期研究,还有糖尿病受试者的I期临床研究。
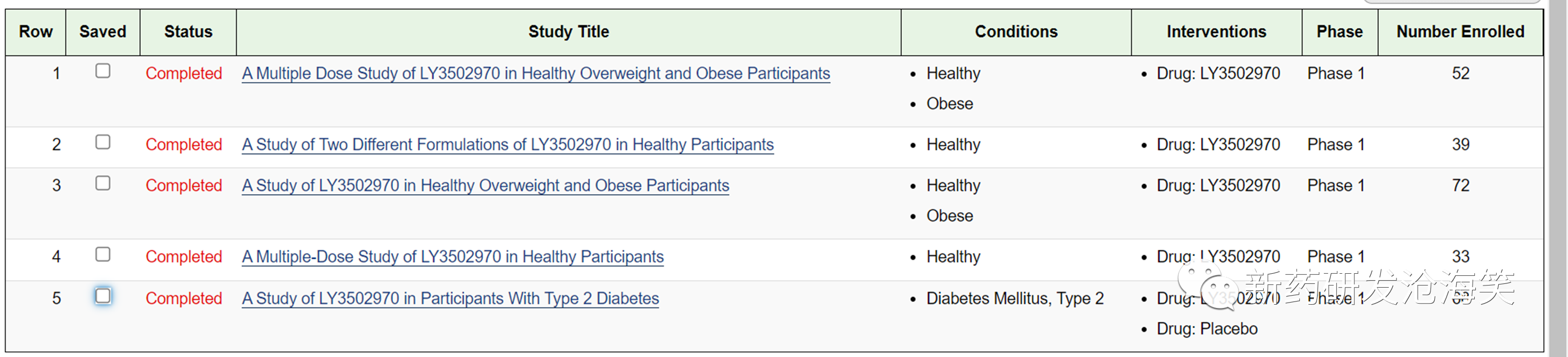
礼来的Ia期MAD探索到24mg,后来增加了一个Ib期,探索到45mg。II期临床有6种给药方案,最高剂量达到45mg。见下图。
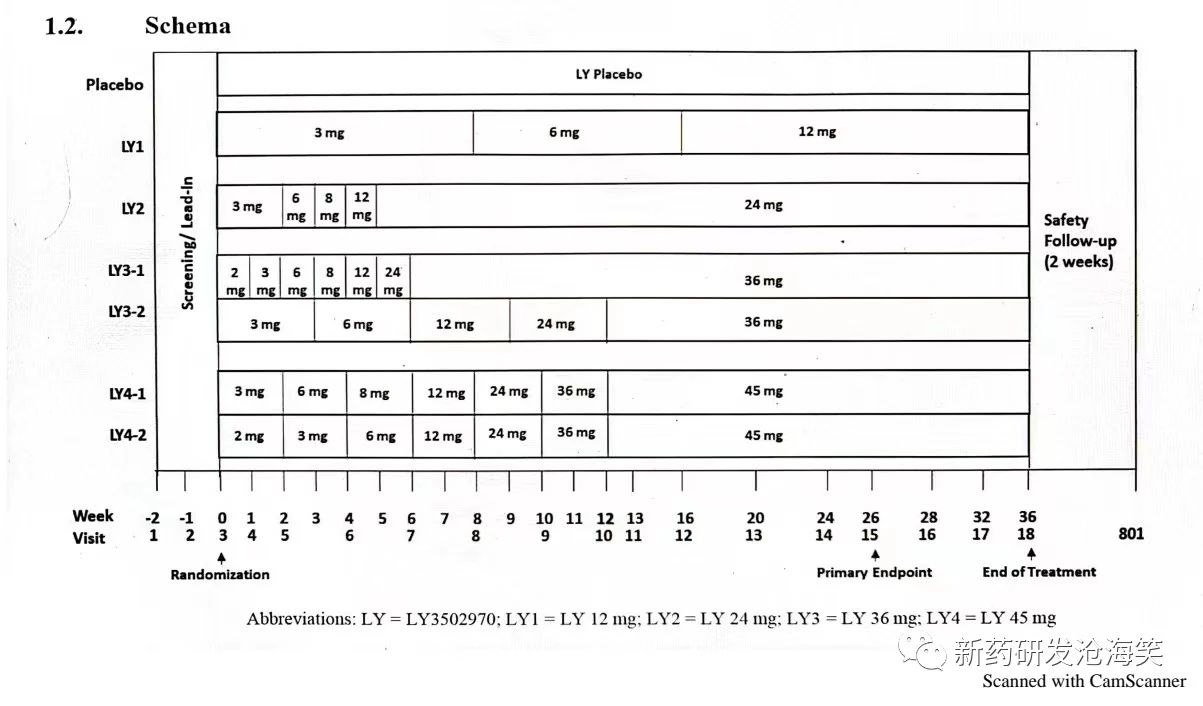
在第26周的主要终点评估中,orforglipron组在所有剂量下均显示出具有统计学意义的剂量依赖性体重减轻,减重范围为8.6%(9.0公斤)至12.6%(13.3公斤),安慰剂组为2.0%(2.1公斤)。服用orforglipron的受试者体重在36周时持续下降,所有剂量的受试者体重都有所降低,减重范围为9.4%(9.8公斤)至14.7%(15.4公斤),而安慰剂组的体重减少了2.3%(2.4公斤)。
总结
以上对比可见,礼来分子在早期临床研究中关注剂量探索,确定新药物的最佳剂量范围,确保患者在接受治疗时能够获得最大的疗效。同时,这充足的剂量还有助于它最小化不良事件的发生,更好地理解药物在人体内的代谢、排泄和药效动力学特性。这些信息对于设计后续临床试验提供了基础,提高试验的成功率。当然,礼来的分子初期也有不足,剂量探索用了2年时间,时间很长,这是因为前期剂量没有探索充足,后来再补充一个继续往上探索,最终找到最佳剂量,获得II期成功。
*本文转载自微信公众号 - - 新药研发沧海笑
相关文件下载、服务及学习课程:
合规文库:ICH Q11 药物的研发和生产(化学实体和生物技术产品/生物制品实体)
合规培训:AAV基因治疗产品CMC开发的合规实践
委托定制:药品注册申请
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点

























