境外医疗器械监管要求
CIO专家-山丹
一、欧盟
根据EU 2017/745法规,欧盟将于今年5月份正式将老版MDD CE认证切换到MDR CE认证(因新冠疫情缘故从20年延期到21年执行),从原先指令上升到法规,不管从要求上还是从内容上,都有一个质的飞跃。目前欧盟授权的公告机构已经停止接收MDD CE认证请求,原有已经拿到MDD CE证书的医疗器械企业,可以继续使用该CE证书出口产品到欧洲直至2024年,但是后续的年审、飞检以及技术文档的更新,均需要按照MDR要求来执行。
医疗器械法规(MDR)[REGULATION(EU)2017/745]修订条例:
https://eur-lex.europa.eu/eli/reg/2020/561/oj
(一)CE认证范围
MDR产品范围包括:
a. MDD(93/42/EEC),AIMDD(90/385/EEC)指令涵盖的医疗器械产品;
b. 医疗器械的定义将扩大到包括以前未管制的非医疗和美容器械。包括用于清洁,消毒或灭菌设备以及隐形眼镜,抽脂设备或脱毛激光器的产品。用于医疗器械清洁、消毒或灭菌的产品;
c. Annex XVI列举的无预期医疗目的产品;(如:美瞳/隐形眼镜等)
d. 某些药械结合产品;
e. 包含IVD部分的医疗器械;
f. 包含声称仅具有美容目的或另一种非医疗目的,但在功能和风险特征方面类似于医疗器械的特定产品组。
(二)分类
欧盟将医疗器械分为四类:Ⅰ类、Ⅱa类、Ⅱb类和Ⅲ类(分类标准见文末注释)。Ⅲ类医疗器械的风险最高。目前,欧盟更新了新的新监管系统,分类标准更加严格,许多医疗设备的类别发生了变化。
Ⅰ类医疗器械:
医疗器械类Ⅰ的风险最低。此类设备的制造商可以选择三种可能的CE标记途径中的一种。但应该考虑以下几点:
(1)医疗器械是否是无菌的,例如个人防护套件;
(2)医疗器械是否具有测量功能,如听诊器;
(3)医疗器械既不是无菌的,也不是测量的,例如矫正眼镜。
注意:如果要认证的产品是Ⅰ类产品,并且它不是无菌或测量设备,那么只需对其进行自我认证,并通过书面声明正式声明其符合MDD的适用要求。如果是无菌或测量医疗设备,那么将需要认证机构评估。
Ⅱa类医疗器械:
Ⅱa类医疗器械包括手术手套、助听器、诊断超声机等,通常为中低风险。患者短期使用,不超过30天。如果申请Ⅱa类医疗设备认证,商家必须支持其声明符合认证机构评估,才能将产品投放市场。有四种可能的途径可以让您的产品获得CE标志,根据产品的类型(即是否无菌)分为两组。
Ⅱb类医疗器械:
Ⅱb类器械包括长期矫正隐形眼镜、手术激光、除颤器等,属于中高风险设备。患者可能会使用期超过30天。如果申请认证的产品属于Ⅱb类,类似于Ⅱa类的程序,商家需要指定机构来评估产品的技术文档是否符合医疗器械指令。特定CE标志路线的选择将再次取决于产品类型。
Ⅲ类医疗器械:
Ⅲ类器械包括心血管导管、动脉瘤夹、髋关节植入物、人工心脏瓣膜等。该类别的所有医疗设备都具有最高的风险,需要在其生命周期内进行永久监控,并有专门的机构负责对产品进行监测。Ⅲ类和Ⅱ类医疗器械的合格评定包括对技术文件的审核和质量体系/产品检查,并侧重于器械设计和生产的一个或多个方面。
二、新加坡
在新加坡,医疗器械(体外诊断设备是作为医疗器械的一个子集)是由新加坡卫生科学局(HSA)下属的医疗器械部门负责监管的。新加坡作为一个卫生高度监管的国家,对于整个框架体系的要求是比较严格,整体要求和欧美比较贴近。
主要框架基于如下三份法案:
1. Health Products Act 2007
2. Health Products (Medical Devices) Regulations 2010
3. ASEAN Medical Devices Directive (AMDD)
(一)监管机构
在新加坡,医疗器械的监管机构是新加坡卫生科学局(Health Sciences Authority, HSA)。HSA成立于2001年4月,隶属于新加坡卫生部(Ministry of Health (MOH) Singapore),是负责监管西药、医疗器械、辅助健康产品、化妆品等产品的新加坡法定机构。
(二)定义及分类
在新加坡,医疗器械大致分为:常规医疗器械和体外诊断器械(IVD)两大类;按安全风险高低,又分为A、B、C、D四个类别。
| 类别 | 风险等级 | 示例 |
| 常规医疗器械分类 | ||
| A | 低风险 | 医用扩张器、压舌板 |
| B | 低-中度风险 | 皮下注射针、吸入式设备 |
| C | 中-高度风险 | 肺通气、接骨板 |
| D | 高风险 | 心脏瓣膜、可植入除颤器 |
| 体外诊断医疗器械 | ||
| A | 低个人风险和低公告健康风险 | 标本采集管、常规培养基 |
| B | 中等个人风险和/或低公众健康风险 | 妊娠试验、抗核抗体实验、尿试纸 |
| C | 高个人风险和/或中等公众健康风险 | 血糖测试、HLA分型测试、PSA筛查、风疹试验 |
| D | 高个人风险和高公众健康风险 | HIVABO血液分组测试筛查 |
注:在新加坡经营医疗器械产品,经销商须通过医疗器械信息与通讯系统(MEDICS)在线提交申请。所有经销商必须注册会计和公司监管账户,并使用客户注册和身份鉴定服务(CRIS)账户来登陆MEDICS系统。一旦获准授权,授权的员工或服务提供商可使用政府交易通用密码SingPass或健康局验证码HSA PIN登陆MEDICS系统。
B、C、D类产品的申请材料包括,参照东盟通用提交资料模板(CSDT)准备的英文申请,相关证书、报告和标签复印件。同时,还应提交良好的流通规范证书(GDPMDS)或医疗器械质量管理体系ISO 13485证书。申请公司应指定一名主要联系人,负责与主管部门联络与申请相关的所有问题,包括按要求补充材料。申请人应遵守所有的注册后条款。
Singapore Government Agency Website:
https://www.hsa.gov.sg/medical-devices/international-collaboration-medical-devices/amdc
(三)新加坡国内关于医疗器械市场准入法规清单
01. Health Products Act 2007
02. Health Products (Medical Devices) Regulations 2010
03. GN-15-R9 guidance on medical device product registration
04. GN-36-R2 guidance on medical device udi system
05. GN-34-R1.3 guidance document for ivd analysers
06. medical devices product classification guide
07. gn-17-r2 guidance on preparation of a product registration submission for gmd using the asean csdt
08. gn-18-r2 guidance on preparation of a product registration submission for ivd md using the asean csdt
09. gn-13-r2-1 guidance on the risk classification of general medical devices
10. gn-14-r3 guidance on the risk classification of in vitro diagnostic md
11. gn-12-1-r2-1 guidance on grouping of medical devices for product registration - general grouping criteria
12. gn-12-2-r2 guidance on grouping specific
13. gn-23-r2 guidance on labelling for medical devices
14. gn-20-r2 guidance on clinical evaluation
15. gn-11-r1-3 guidance on the declaration of conformity
16. gn-16-r3 guidance on essential principles for safety and performance of medical devices
17. tr-01-r2 contents of a product registration submission for gmd using the asean csdt
18. tr-02-r2 contents of a product registration submission for in vitro diagnostic medical devices using the asean csdt
19. gn-02-r5 guidance on licensing of manufacturers importers and wholesalers of md
20. gn-03-r3 guidance on preparation of a site master file for licensing
21. gn-22-r7-4 guidance for dealers on class a medical devices
22. gn-33-r1-2 guidance on the application of singapore standard gdpmds
23. gn-06-r3 guidance on distribution records
24. gn-21-r5 guidance on change notification for registered md
25. change notifications arising from the eu mdrivdr related changes
26. gn-24-r1-4 guidance on the change of registrant
27. gn-25-r1 guidance on the cancellation of medical device listing
28. gn-35-r4 guidance on special access routes
29. gn-08-r2 guidance on medical device advertisements and sales promotion
30. gn-05-r2-1 guidance on the reporting of adverse events
31. gn-10-r3-6 guidance on medical device field safety corrective action
32. gn-04-r2-2 guidance on medical device recall
33. gn-07-r2-2 guidance on complaint handling
34. gn-09-r3-6 guidance on the component elements of a dhcpl
35. gl-08-r1 regulatory guidelines for laboratory developed tests (ldts)
36. regulatory guidelines for software medical devices - a life cycle approach_r2
37. guidelines risk classification samd-cdss
三、泰国
TFDA是泰国食品药品监督管理局(Thailand Food and Drug Administration),进入泰国的化妆品、医疗器械,食品,药品,补充剂,用于保健的产品或其他医学,麻醉和有毒物质均需要泰国食品药品监督管理局(FDA)注册。监管程序基于《医疗器械法》B.E. 2551(2008),并由《医疗器械法/条例》B.E. 2562(2019)更新。
在设备可以进口到泰国或在泰国销售之前,必须从泰国FDA获得进口许可证。新法规下的合格评定将要求以通用提交档案模板(CSDT)格式提交第2-4类产品的申请,而第1类列出的产品需要较少的文件。还需要当地注册人和许可证持有人的泰国FDA颁发的机构许可证。在泰国,产品许可证持有人也可以同时作为进口商和分销商。
(一)分类规则及审核周期
Thai FDA根据风险高低将医疗器械(含体外诊断医疗器械)划分为1、2、3、4类:1类风险最低,2类、3类居中,4类风险最高。
| 产品分类 | 风险等级 | 符合性路径 |
| Class 1 | 低 | 产品列名 Listed Medical Devices |
| Class 2 | 中低 | 上市前通告 Notified Medical Devices |
| Class 3 | 中高 | 上市前通告 Notified Medical Devices |
| Class 4 | 高 | 产品注册 Licensed Medical Devices |
审核周期:
| 产品分类 | 风险等级 | 预计注册周期 |
| Class 1 | 低 | 约30天 |
| Class 2 | 中低 | 约250天 |
| Class 3 | 中高 | 约250天 |
| Class 4 | 高 | 约1年 |
根据Thai FDA发布的《RISK CLASSIFICATION OF MEDICAL DEVICES,B.E. 2562(2019)》的7条分类规则,确定注册产品的分类。
四、马来西亚
马来西亚的医疗器械管理法是《医疗器械管理法(2012)》,该法规的基本框架比较接近美国的医疗器械管理法规。
根据2012年医疗器械法的规定,马来西亚的医疗器械产品注册由马来西亚卫生部(MoHM)医疗器械管理局(Medical Device Authority,MDA)监管,该法于2013年7月1日生效。根据该法,医疗器械在进口和投放市场之前需要在MDA注册。
马来西亚-医疗器械管理局(MDA)官网(马来西亚医疗器械法规及指南文件):
https://www.mda.gov.my/
(一)分类
根据马来西亚医疗器械管理法规,医疗器械按风险从低到高分为A类、B类、C类和D类四类。其中,A类医疗器械风险最低,B类和C类居中,D类风险最高。
A类产品:低风险,如细胞计数仪。
B类产品:中低风险,如尿液分析仪。
C类产品:中高风险,如心电图仪。
D类产品:高风险,如血液透析机。
在医疗器械出口到马来西亚的过程中,需要注意以下事项:
1. 目前马来西亚注册已不再需要自由销售证书(Free Sales Certificate,FSC)。
2. 必须在马来西亚指定的当地代表处提交注册申请。
3. 每个产品只能有一个产品许可证持有人(即持证人)。
4. 产品许可证可以转让给其他持有人。
5. 所有制造商需要获得ISO 13485认证,作为申请注册的必备条件。
五、韩国
韩国MFDS全称Ministry of Food and Drug Safety,即韩国食品药品管理局,主要负责食品,药品,医疗器械和化妆品的安全,食品和制药工业发展,以及促进公共健康。
韩国食品和药品安全部官网(关注韩国Medical Devices模块的变化):
https://www.mfds.go.kr/eng/index.do
(一)法规
20201221-《医疗器械监督管理条例》(NMPA2021修订版)
20141001-《医疗器械注册管理办法》(CFDA令第4号)
20141001-《医疗器械说明书和标签管理规定》(CFDA令第6号)
20140530-CFDA关于发布医疗器械产品技术要求编写指导原则的通告(第9号)
20141001-CFDA关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2014年第43号)
(二)分类
韩国按照危险程度、与人体的接触面积和接触时间、产品的安全性和有效性将医疗器械分为4类(Ⅰ、Ⅱ、Ⅲ、Ⅳ),这种分类方法与欧盟对医疗器械的分类方法非常相似。
Ⅰ类:几乎没有潜在危险的医疗器械;
Ⅱ类:具有低潜在危险的医疗器械;
Ⅲ类:具有中度潜在危险的医疗器械;
Ⅳ类:高风险的医疗器械。
MFDS要求医疗器械的认证和批准应提交“技术文档”。原则上,Ⅰ和Ⅱ类器械由“医疗器械信息和技术援助中心(MDITAC)”和国家医疗器械安全信息研究所(NIDS)认证,Ⅲ和Ⅳ类器械由MFDS批准。然而,Ⅰ类和Ⅱ类设备在以下情况必须由MFDS批准。
- 那些需要提供临床试验报告的
- 数字化医疗相关的(如远程医疗系统)
- 未定义的命名法和分类规则的
- 与药品等结合的
基于医疗器械的风险分类,每一类器械都有不同的市场准入途径。官方给出的审批流程,Ⅰ类器械的官方审核时间约为2个月,Ⅱ类器械约为4-7个月,Ⅲ,Ⅳ类约为145个工作日。
另外,在韩国生产医疗器械和从国外进口医疗器械到韩国的,应分别取得生产经营许可证和进口经营许可证。营业许可证审批由经营场所所在地的MFDS有关地区办事处办理。由于申请人必须持有至少一个产品许可证才能获得营业许可证,所以营业许可证和产品许可证的审批过程同时进行。
出口到韩国的Ⅱ,Ⅲ,Ⅳ类医疗器械制造商都需要符合KGMP(Korean Good Manufacturing Practice)的要求,KGMP的要求与ISO 13485相类似。KGMP证书是颁发给进口商(Importor)而不是生产商(Manufacturer),证书每3年更新一次,在证书过期前的90天更新。通常高风险的Ⅲ,Ⅳ类医疗器械制造商的KGMP都由监管当局MFDS审核,而Ⅱ类和部分的Ⅲ,Ⅳ类的医疗器械交由第三方机构审核,第三方机构即TPA(Third Party Auditor),TPA的加入,分担了MFDS的工作量,大大缩短了审核周期。
六、香港
卫生部-医疗器械官网(关注香港医疗器械“醫療儀器行政管理制度”):
https://www.mdd.gov.hk/tc/home/index.html
香港医疗器械的监管机构是医疗仪器科,香港将医疗器械按风险等级分为Ⅰ,Ⅱ,Ⅲ,Ⅳ四个等级;除了Ⅰ等级,其他等级的医疗器械进入香港市场,要求自愿向医疗仪器管制办公室提交产品注册列名,已注册的列名产品将会在官方网站向公众展示,获得批准后的有效期是5年。本地负责人(LRP)需要在到期前最少3个月内提供延期申请。如果延期未在要求时间内提出,可能会在期满后被除名。
把一般医疗仪器按其风险分为四级(第Ⅰ至第Ⅳ级),第Ⅳ级的风险最高,而第Ⅰ级的风险最低。
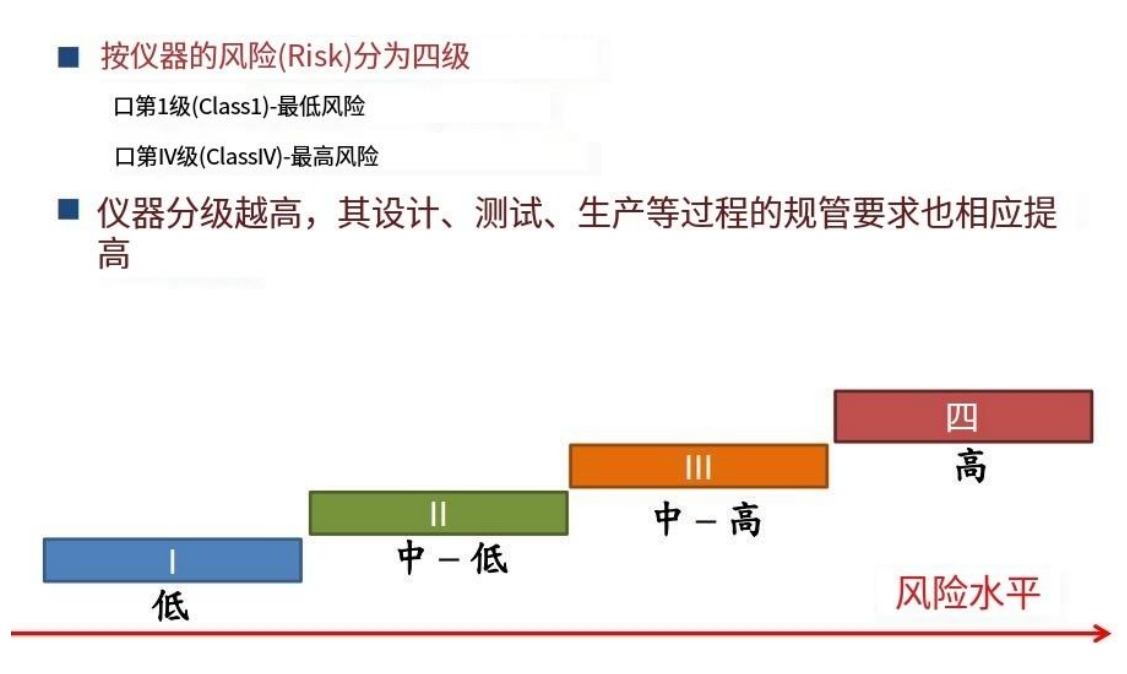
香港的医疗器械行政管理涵盖了上市前监管和上市后监管。上市前监管包括表列制度和CAB认可制度,而上市后监管包括产品安全警报和医疗事故呈报制度。

上市前监管:
1. 表列制度涵盖了不同级别的医疗器械(Ⅱ、Ⅲ和Ⅳ级)以及D级IVD,还包括本地制造商、进口商和分销商的表列制度。
表列制度概述:本地负责人指的是在香港没有办事处的公司必须委任的人员。本地负责人必须是在香港注册成立的法人,或者在香港拥有商业登记证的自然人或法人。本地负责人负责申请医疗器械表列,并在表列证书上标明其名称。此外,本地负责人还负责上市后的服务职责,包括不良事故报告、投诉处理和召回等。
2. CAB认可制度是指获得医疗仪器管制办公室认可的认证评核机构。这些机构有资格进行认证评核程序,以确定受评仪器是否符合医疗仪器行政管理制度的规定。
认证评核要项包括质量管理系统、推出市面后的监察系统、技术文件摘要、符合声明及医疗仪器科实施的医疗仪器表列制度。对于第Ⅱ、第Ⅲ及第Ⅳ级医疗仪器,以上五个要项都是必需的。如在某一认证评核要项中,有可供选择的不同程序,制造商可选择一个他认为是最适当的程序。
上市后监管:
产品安全警报和医疗事故呈报制度要求本地负责人根据医疗仪器行政管理制度,在香港发生的事故必须进行呈报,而在香港以外发生的事故则不需要呈报。
七、台湾
台湾行政院卫生著食品药品管理局(Taiwan FoodandDrugAdministration,简称TFDA),负责监管在台湾上市的医疗器械。
(衛生福利部:https://nbrp.sinica.edu.tw/pages/20)
自2021年5月起,监管系统将受新的医疗器械法管辖。根据《医疗器械法》,“医疗器械”一词是指体外使用的仪器、机器、装置、材料、软件、试剂及其相关物品,其设计和使用达到以下主要预期作用之一或通过药理学、免疫学、代谢或化学以外的方式对人体:
1. 对人类疾病的诊断、治疗、缓解或直接预防。
2. 改变或改善人体的结构和功能。
3. 受孕的控制。
另依據醫療器材分類分級管理辦法,醫療器材依功能、用途、使用方法及工作原理,視其應用科分為16大類,並依風險程度,分為以下三個等級:第一等級(低風險性)、第二等級(中風險性)及第三等級(高風險性)。
● 醫療器材登錄:
醫療器材上市後安全:醫療器材上市後管理,主要為確保市售醫療器材之品質與安全,部分特定高風險醫療器材須執行安全監視,醫事機構並應協助配合辦理。業者亦應主動監控上市後產品之風險管理,進行必要矯正預防措施。
有關醫療器材定期安全監視報告、醫療器材嚴重不良事件通報及主動通報醫療器材安全危害警訊等相關規定或繳交方式,可至醫療器材上市後安全專區查詢。
● 醫療器材商:
欲製造、販賣或供應醫療器材者,應先取得醫療器材商許可執照。
醫療器材商包含醫療器材製造業者或販賣業者,其可執行業務分述如下:
醫療器材製造業者:
一、從事醫療器材製造、包裝、貼標、滅菌或最終驗放。
二、從事醫療器材設計,並以其名義於市場流通。
醫療器材販賣業者:
經營醫療器材之批發、零售、輸入、輸出、租賃或維修之業者。醫療器材製造業者或販賣業者,應向所在地衛生局辦理登記,詳細規定請參考醫療器材商及其技術人員管理專區。
● 醫療器材流向管理:
依醫療器材來源流向資料建立及管理辦法,經中央主管機關公告一定風險等級之醫療器材,醫療器材商及醫事機構應建立與保存產品直接供應來源及流向之資料;另經中央主管機關公告之品項,前項建立及保存之資料應向中央主管機關申報。前述「應建立與保存來源及流向資料之醫療器材」及「應申報來源及流向資料之醫療器材品項」,其品項範圍、資料建立與保存方式、保存年限、申報內容、方式及其他應遵行事項之辦法,請至醫療器材來源流向暨單一識別系統(UDI)專區查詢。
附:
东南亚联盟 ASEAN——医疗器械新法规“AMDD”
2015年,东南亚国家联盟(ASEAN)签署了一项协议,即《东盟医疗器械指令》(AMDD),旨在协调医疗器械法规。AMDD的一个重要元素是东盟共同提交档案模板(CSDT),这是一个信息和要求的集合,允许设备制造商向东盟成员国的不同监管机构提供相同的产品注册文件。
(一)分类
AMDD根据风险等级将医疗器械分为四类。A类产品为低风险,B类产品为中低风险,C类产品为中高风险,D类产品为高风险。
东盟医疗器械指令(AMDD)由东南亚十个国家组成,包括文莱达鲁萨兰国、柬埔寨、印度尼西亚、老挝人民民主共和国、马来西亚、缅甸、菲律宾、新加坡、泰国和越南。这些国家处于适应和实施指令的不同阶段。简单来说:
● 新加坡、马来西亚和印度尼西亚处于提前阶段,并已完全遵守AMDD。
● 菲律宾、泰国和柬埔寨已修订其国家法规以符合指令的某些要求。尚未进行更多更改以完全符合AMDD。
● 老挝和缅甸正在制定新法规。
(二)审核途径
虽然ASEAN十国,分类规则相同,但审核路径却不尽相同:
1. 泰国:低风险的Ⅰ类设备必须在泰国进口和销售之前列名,而Ⅱ类和Ⅲ类设备必须得到通知,Ⅳ类设备必须获得批准的许可证才能投放泰国市场。泰国不再需要自由销售证明或原产国出具的CFS。
2. 马来西亚:A类产品,由当地授权代表AR向MDA申请A类产品的注册,不需要得到其认可的合格评定机构CAB的批准。B、C、D类产品,当地授权代表AR提交B、C、D级产品的技术报告。MDA合格评定的第三方机构CAB进行技术文件审查。得到参考国(如澳大利亚、加拿大、欧盟、日本、美国)批准和销售的医疗器械将通过简化程序审核,但非必须。
3. 新加坡:A类无菌、B类、C类和D类医疗器械必须先提交给HSA,然后才能在新加坡供应。HSA为企业提供了四条认证路径以满足不同企业需求:已获得参考国/地区(澳大利亚、加拿大、日本、美国、欧盟)至少一项批准的医疗器械可简化或加急评估途径;未获得任何参考监管地区事先批准的医疗器械,可通过完整或完整优先评估途径申请注册。
(三)申请条件及注意事项
1. 质量体系合格评定
所有制造商都需要ISO 13485,授权代表需要在公司执照中具有法人实体和正确的范围,进口商、分销商需要有相应的许可证。
2. 必要文件要求
外国制造商的授权书;
原产国自由销售或出口证明(新加坡、马来西亚、泰国无需);
ISO 13485证书;
工艺流程图;
灭菌方法(如适用);
产品样品分析证明;
当地代表的营业执照/公司注册证书。
3. 许可证持有人要求
外国制造商如想在上述国家注册自己的产品,必须由当地代理人代为申请并持有许可证。
马来西亚要求授权代表AR必须拥有营业执照和医疗器械良好分销规范(GDPMD)证书。
新加坡要求授权代表必须拥有符合GDPMDS或ISO 13485的经销商许可证。
相关文件下载、服务及学习课程:
合规文库:医疗器械监督管理条例
合规培训:新形势下IVD临床试验难点与关注要点
委托定制:医疗器械产品出口销售证明
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点

























