贴敷类医疗器械产品注册资料——对产品描述的讲解
CIO专家-谷芽
随着对第二类器械中,关于敷料类产品注册的要求越来越细化,对所需要提交注册产品的资料要求也随之越来越高,而且根据国家总局的要求,各个省份也分别对这类产品的注册采取更加明细规范化的要求,正因为如此,对于产品在注册资料准备过程中,如何准确而又清晰的对注册产品进行描述,就成了一个绕不开的话题。
如果对产品要素的描述不够准确,则不能达到技术审评的要点。同时对产品的技术特性与产品相关的应用要求表述不明确,则又会让注册资料缺少基本的技术评审价值,针对这个情况,这里做一个简短的探讨。
首先要从产品综述的基本概念出发,必须在资料中体现以下几点:
1.对产品采用的技术原理,产品组成及原材料的来源与产品加工工艺和检验或验证方法进行描写。这里面有几个特别要注意的地方是:
产品原材料的安全性要与所提的检验验方法能够对应。
产品技术原理不能超越第二类医疗器械的基本要求,即要能够确认是属于不被人体所吸收,不会产生药理性反应的基本要求。
2.产品的研究成果的总结与评价,应当包括分析性能评估与稳定性基本评价等要求。
3.在描述所使用的原材料中,如果存在生物材料或是衍生物(如适用),包括生物学来源(如 人 动物 病源体 或是重组与发酵产物)及生物组织来源,人源性材料须对有关传染病病源体检测并进行说明,其它类别的生物源(动物源或是微生物源)必须能够提供产品的安全性解释说明。
4.产品描述中,对于包装的说明。首先,需要有对包装材料与敷料料体兼容性或是稳定性测试的证明,这个是很多注册单位不够重视的地方,根据目前的要求是一定要对包装材(重点是内包材)进行有效的兼容性测评,同时对包装材料的说明,还应当包括对于产品包装的形态进行描述。
5.针对产品研发历程的描述。这点非常具有技巧性。如果是阐述申请注册的产品研发背景与目的过程中,没有同类产品或前代产品用来进行对照,则自身需要提供的各种检测与证明性资料会比较繁琐。但是如引用同类产品或前代产品进行研发对照,则又需要提供同类产品或是前代产品的信息,这里面就必须会引用到一些对照数,而这些数据大至所需要涉及的范围可以参照下表来考虑:
境内(外)已有同类产品上市引用对照
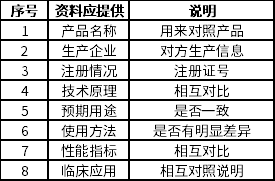
境内(外)暂无同类产品上市引用对照
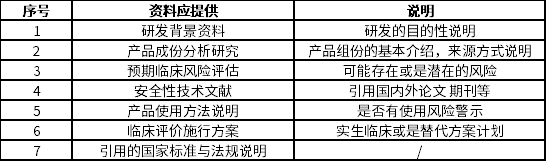
总之,对于敷料在第二类医疗器械注册过程中,对于产品描述是比较重要的一环,在药监部门技术评定过程中,会看得比较仔细,也会仔细对比产品描述的内容。如果在注册资料填报过程中,产品描述越清晰和简要,对于后期的技术评定是一个好开端。
贴敷类医疗器械产品注册有一定难度,上文所述的产品描述只是产品注册其中一环,后续还有研究资料、临床资料、非临床资料等编写要点需要注意。CIO合规保证组织为有贴敷类医疗器械注册的企业,提供申请注册的全套资料的审核与确认,助力二三类医疗器械成功注册上市。如有需要,点击下方联系CIO。
相关文件下载、服务及学习课程:
合规文库:第二类医疗器械注册证核发申请资料包
合规培训:医疗器械分类知识
合规服务:医疗器械注册证办理
联系专家,获取专家指导意见:e邀专家
























