药监局:19个二类医疗器械降为一类,新增1个一类医疗器械
CIO专家-元参
昨日,国家药监局综合司发布《公开征求
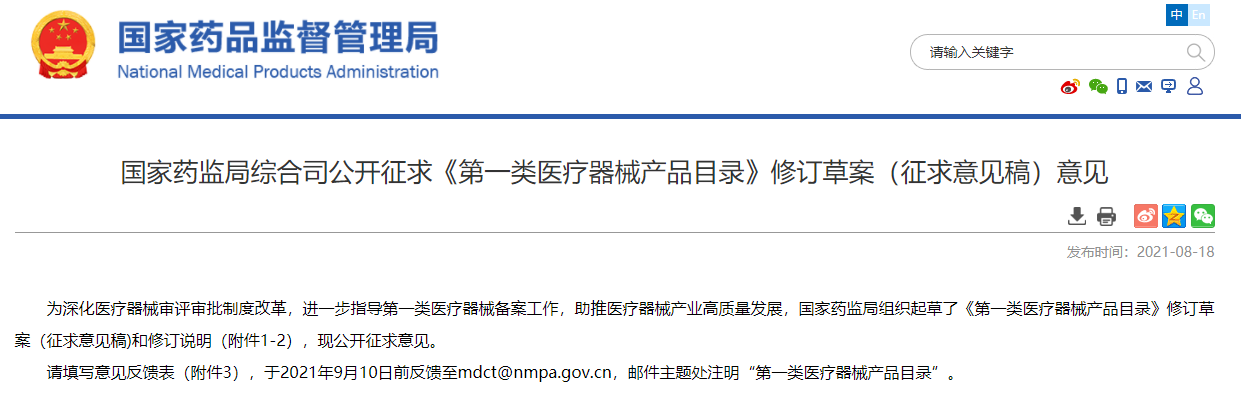
新增的一类医疗器械为“眼球突出计”,属于眼科器械中眼科植入物及辅助器,用于检查眼球角膜顶突出眶缘高度。
原19个二类医疗器械降为一类的器械分别是:肺功能测试设备、体表色素测量设备、呼吸管路辅助器械、雾化面罩、输氧面罩、光治疗设备附件、加压治疗设备、臭氧治疗设备、义眼片、口腔成像辅助器具、种植用设备、口腔用骨粉制备设备、皮肤针、滚针、红细胞沉降仪器、微生物比浊仪器、医用显微镜、血液及样本采集卡、计数板。
此外,草案目录还编制了第一类医疗器械产品禁止添加成分名录,第一类医疗器械产品目录中“06-08-01超声耦合剂” “09-02-03物理降温设备”“09-03-08光治疗设备附件”“14-10-02创口贴”“14-10-08液体、膏状敷料”中的产品不能含有中药、化学药物、生物制品、消毒和抗菌成分、天然植物及其提取物等发挥药理学、免疫学或者代谢作用成分或可被人体吸收的成分,包括但不限于下表所列成分。

二类医疗器械降为一类,以上19种医疗器械也由注册变为备案,备案流程更简单,资料也容易准备,不需要进行医疗器械体系考核,那么一类医疗器械备案需要准备什么资料呢?
(一)产品风险分析资料;
(二)产品技术要求;
(三)产品检验报告;
(四)临床评价资料
(五)产品说明书以及标签样稿;
(六)与产品研制、生产有关的质量管理体系文件;
(七)证明产品安全、有效所需的其他资料。
虽然备案简单了,但是资料编写还是有一定难度的,在资料准备和产品送检中碰到问题,可以咨询CIO合规保证组织。
CIO合规保证组织,专注于研究医药监管科学,在药品、医疗器械、化妆品、保健食品等领域,构建了产品研发、临床研究、注册、生产、流通、使用、不良反应、药物警戒等全生命周期中所有核心环节的服务体系,用审计、顾问、培训、认证等服务方式,为各地药监部门、企业、投资者、从业者等提供优质的服务。
相关文件下载、服务及学习课程:
合规文库:
合规培训:
合规服务:
远程服务:























