又有医疗器械飞行检查出问题,来看医疗器械监督管理条例怎么说
CIO专家-白芨
7月初,广东省药品监督管理局发布一则医疗器械飞检通知,某医疗器械生产企业在飞检中被发现生产质量管理体系存严重缺陷,不符合医疗器械生产质量管理规范相关规定,现已停产整改,并召回相关产品。
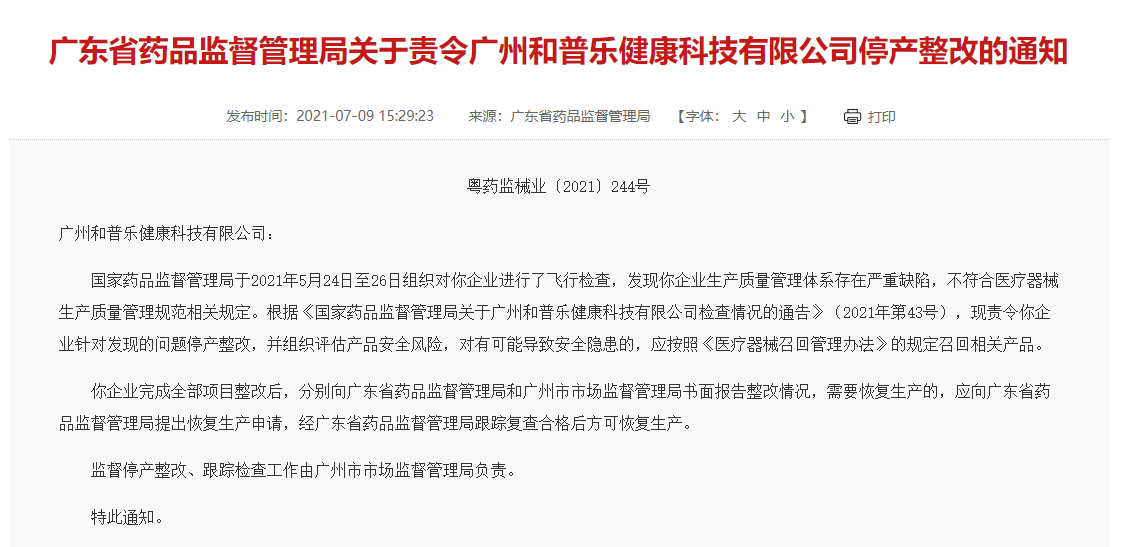
一、存严重缺陷可吊销医疗器械生产许可证
此次飞检通知高亮的“和普乐健康科技”主要生产呼吸机和正压面罩,呼吸机和正压面罩属于二、三类医疗器械,是具有中高风险的医疗器械,在药监局的重点关注名单里。CIO合规保证组织小编查找了6月1日开始施行的新《医疗器械监督管理条例》,第八十八条指出,生产条件发生变化、不再符合医疗器械质量管理体系要求,未依照本条例规定整改、停止生产、报告,由负责药品监督管理的部门责令改正,处1万元以上5万元以下罚款;拒不改正的,处5万元以上10万元以下罚款;情节严重的,责令停产停业,直至由原发证部门吊销医疗器械生产许可证、医疗器械经营许可证,对违法单位的法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入30%以上2倍以下罚款,5年内禁止其从事医疗器械生产经营活动。
二、建立生产质量管理体系应该注意几点
那么和普乐健康科技生产质量管理体系存严重缺陷,主要体现在哪几个方面?CIO合规保证组织小编总结了以下几点,主要集中在生产管理、质量管理和不良事件检测上。
1、生产管理方面:
(1)企业持续正压呼吸机关键工序“打动平衡”使用的动平衡机有2种,但该工序作业指导书未全部涵盖,缺少动平衡值设定等参数的规定,不符合《医疗器械生产质量管理规范》(以下简称《规范》)中企业应当编制生产工艺规程、作业指导书等,明确关键工序和特殊过程的要求。
(2)企业批号为211803的“8系正压通气治疗机”,其中 1件物料批号为202609的主控板PCBA作为不良品退回原料库按“拆解零部件”处置,但该批产品的领料记录和主板调测试记录数量均为“200”且“合格”;主机生产工序流转卡记录“半成品自检已完成”,但制程巡检记录未填写;该批记录中老化数量为50台,现场核对老化数量为52台,不符合《规范》中每批(台)产品均应当有生产记录,并满足可追溯的要求。
2、质量控制方面:
(1)企业未按照《持续正压呼吸机》产品技术要求规定,采用符合YY/T1040.1-2015规定的接头,并对通气管道接口连接牢固度进行测试,不符合《规范》中企业应当根据强制性标准以及经注册或者备案的产品技术要求制定产品的检验规程,并出具相应的检验报告或者证书的要求。
(2)企业持续正压呼吸机批检验记录中压力误差检验记录未记录三个压力值的误差原始记录;周期检验记录中静态压力稳定度未按照规定保存原始记录;最大气体流量未按照规定保存原始记录;未记录检验过程中使用的流量计和湿度测试仪器;未记录压力误差测试过程中对被测品参数的调整,不符合《规范》中每批(台)产品均应当有批检验记录,并满足可追溯的要求。
3、不良事件监测、分析和改进方面:
查看编号为T117-200610-001的医疗器械召回调查评估报告,企业未对抽验不合格涉及的相同生产批号已销售产品进行分析,不符合《规范》中对于存在安全隐患的医疗器械,企业应当按照有关法规要求采取召回等措施,并按规定向有关部门报告的要求。该企业质量管理体系存在严重缺陷,不符合医疗器械生产质量管理规范相关规定。该企业已对上述其质量管理体系存在缺陷予以确认。
三、医疗器械企业如何合规生产
CIO合规保证组织有百余人专家团队,为上千家医药企业进行GMP符合性审计,小编在采访了专家后给大家整理出了几点关于医疗器械企业如何合规生产。
1、质量管理体系自查工作是否落实到位,自查报告及各项相关记录是否真实、完整、可追溯。像“和普乐健康科技”中生产记录不完整,没有对应的检验记录,是列入严重缺陷的。
2、是否组织了医疗器械法律法规、质量管理体系、风险管理、产品知识相关的培训,企业与质量相关的人员是否具备与岗位相适应的知识、技能和经验。小编建议医疗器械企业可以借助第三方机构举办合规培训,了解最新的政策,提升操作技能。
3、对发生的不良事件是否进行了情况调查,深入分析原因并采取有效处置措施。“和普乐健康科技”未对抽验不合格涉及的相同生产批号已销售产品进行分析,也没有采取措施比如召回产品,这不是合规生产的表现。
CIO合规保证组织,有18年的行业经验,凝聚了深厚的行业人脉,具有经验丰富的专业咨询团队和专家顾问团队,深入领会政策精髓,精通法规要求,帮助客户主动规避风险,提高合规性,持续为企业提供GMP符合性检查、GMP培训、医疗器械注册/备案、生产和经营许可申办等合规服务。
更多医药合规服务,详看以下链接:
合规文库:
合规培训:
合规服务:
远程服务:


























