前所未有!全球首款“定制耳朵”问世
CIO专家-燕窝
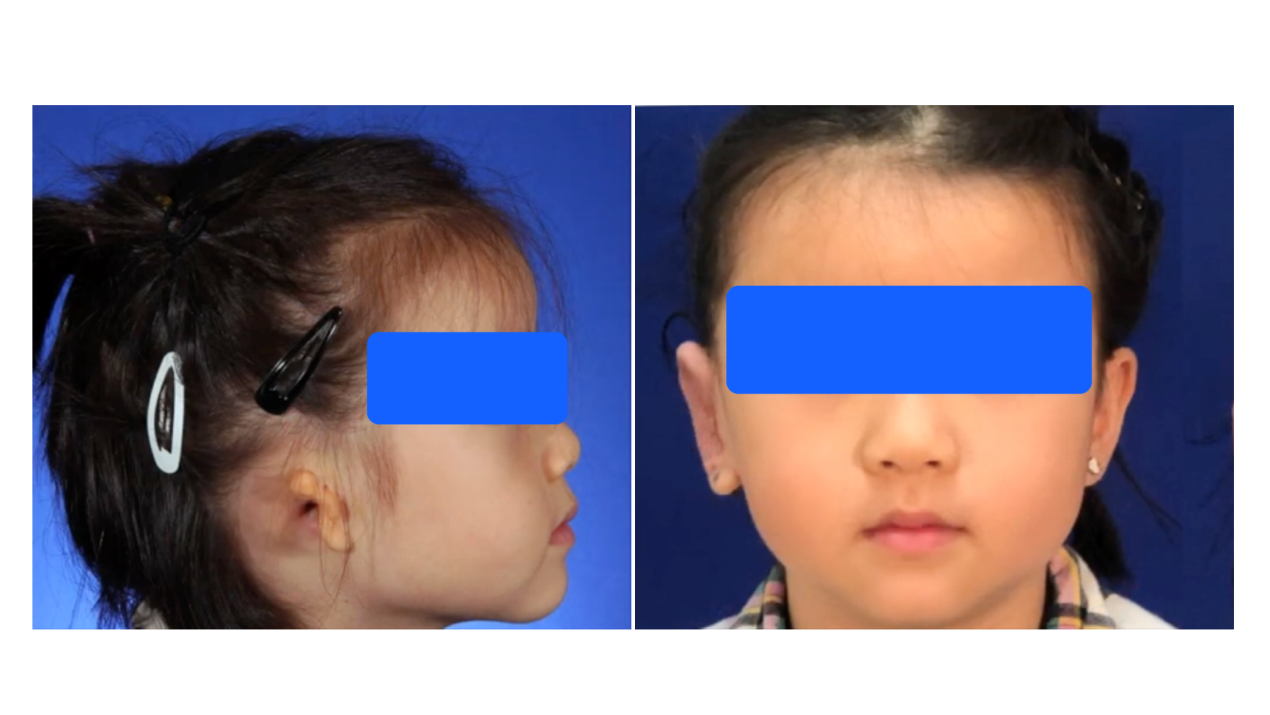
近日,上海市第九人民医院临床专家利用三维一体化定制耳植入物,做出逼真耳朵,为耳缺损患者一次性完成耳重建和听力重建。9岁患儿耳重建和听力重建康复一次完成,不需要接受第二次手术。这在中国乃至亚洲地区此前未见报道。
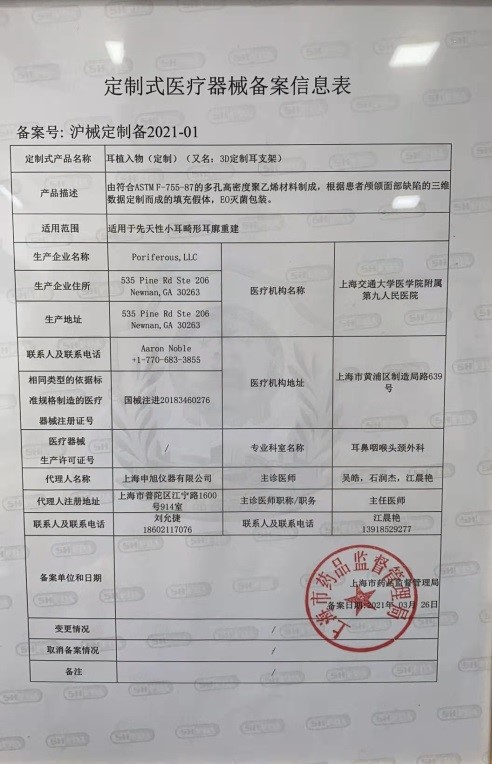
为支持医院使用三维一体化定制耳植入物,今年3月,按照国家《定制式医疗器械监督管理规定》,上海市药品监督管理局向上海九院发放了“耳植入物(定制)”备案凭证(沪械定制备2021-01)。备案不再对产品进行审批,但强调企业和医院的能力,强调已有同类标准产品批准上市,强调备案后监管。备案替代审批,缩短产品上市时间,为临床应急使用和创新发展开出绿色通道。
定制式医疗器械是指为满足指定患者的罕见特殊病损情况,在我国已上市产品难以满足临床需求的情况下,由医疗器械生产企业基于医疗机构特殊临床需求而设计和生产,用于指定患者的、预期能提高诊疗效果的个性化医疗器械。考虑到产品特点,定制式医疗器械难以通过现行注册管理模式进行注册,因此对定制式医疗器械实行上市前备案管理。定制式医疗器械生产企业与医疗机构共同作为备案人,在生产、使用定制式医疗器械前应当向医疗器械生产企业所在地(进口产品为代理人所在地)省、自治区、直辖市药品监督管理部门备案。从风险控制的角度出发,定制式医疗器械不得委托生产,备案人应当具备相应条件。当定制式医疗器械生产企业不具备相同类型的依据标准规格批量生产的医疗器械产品的有效注册证或者生产许可证时,或者主要原材料、技术原理、结构组成、关键性能指标及适用范围基本相同的产品已批准注册的,备案自动失效。备案人应当主动取消备案。
由此可见,相较于部分非定制式医疗器械,对于定制式医疗器械上市前的监管有适当放松,这既是适应临床治疗的需要,又是简政放权、激发市场活力、释放社会创造力的需要。但适当放松上市前监管并不代表没有监管,监管部门对于定制式医疗器械的上市后监管并未放松。上市后监管如生产质量管理体系、医疗器械标签说明书、不良事件监测、产品可追溯性等要求,对定制式医疗器械仍然是适用的。
3D打印是国家重点支持的科研技术,具有广阔的应用前景。近年来,由于3D打印等技术的日趋成熟,我国在定制化医疗器械领域进行了诸多积极尝试。上海九院三维一体化定制耳植入物的成功应用,助力临床医学再攀新高。CIO合规保证组织专家认为,未来,定制式医疗器械器械将通过医工结合,顺应医疗产业发展潮流,以创新科技驱动医疗服务模式大变革。
CIO合规保证组织,专注研究医药监管科学,深耕医疗器械产品研发、生产领域近二十年,构建了医疗器械所有核心环节的服务体系。CIO合规保证组织为企业提供医疗器械产品备案、注册服务,提供医疗器械法律法规咨询、合规风险评估,为中国医药转型升级服务,促进医药产业合规、快速发展。
更多医药合规服务,详看以下链接:
合规文库:医疗器械相关法规政策学习宝典
合规服务:医疗器械产品技术要求编写服务
远程服务:























