基本信息
1、办理部门:辽宁省药品监督管理局
2、办理方式:网上办理
3、办理地点:辽宁省沈阳市皇姑区 崇山中路109号辽宁省政务服务中心 三楼
4、咨询电话:024-83988721,024-31607043 CIO咨询:400-003-0818
受理条件
无
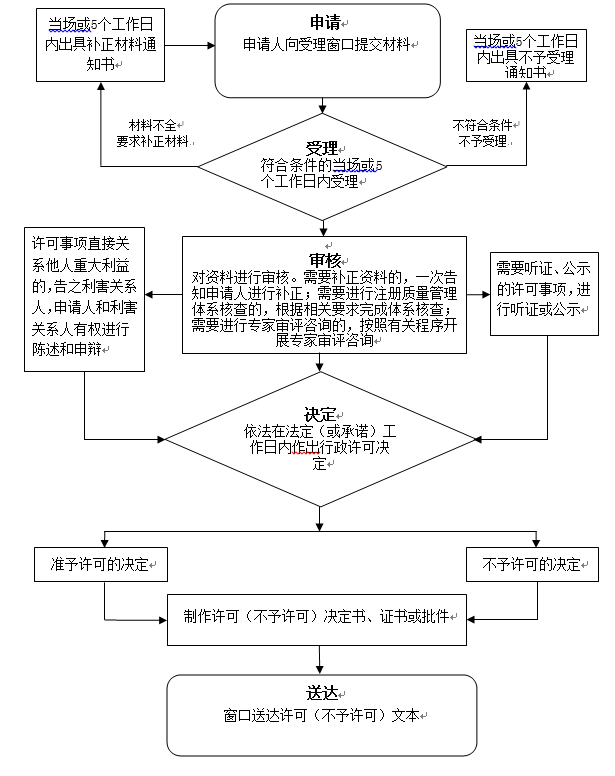
办理流程
流程文字说明
法定办结时限:20个工作日;承诺办结时限:14个工作日
1、申请(时限:5个工作日)
2、受理(时限:5个工作日)
3、审核
4、决定
5、送达
申请材料
1、监管信息-申请表;>>辽宁省体外诊断试剂申请表
2、监管信息-章节目录;
3、监管信息-术语、缩写词列表;
4、监管信息-产品列表;
5、监管信息-关联文件;
6、监管信息-申报前与监管机构的联系情况和沟通记录;
7、监管信息-符合性声明;
8、综述资料-章节目录;
9、综述资料-概述;
10、综述资料-产品描述;
11、综述资料-适用范围和禁忌证;
12、综述资料-申报产品上市历史;
13、综述资料-其他需说明的内容;
14、非临床资料-章节目录;
15、非临床资料-产品风险管理资料;
16、非临床资料-医疗器械安全和性能基本原则清单;
17、非临床资料-产品技术要求及检验报告;
18、非临床资料-研究资料;
19、非临床资料-非临床文献;
20、非临床资料-稳定性研究;
21、非临床资料-其他资料;
22、临床评价资料-章节目录;
23、临床评价资料-临床评价资料;
24、临床评价资料-其他资料;
25、产品说明书和标签样稿-章节目录;
26、产品说明书和标签样稿-产品说明书;
27、产品说明书和标签样稿-标签样稿;
28、产品说明书和标签样稿-其他资料;
29、质量管理体系文件-综述;
30、质量管理体系文件-章节目录;
31、质量管理体系文件-生产制造信息;
32、质量管理体系文件-质量管理体系程序;
33、质量管理体系文件-管理职责程序;
34、质量管理体系文件-资源管理程序;
35、质量管理体系文件-产品实现程序;
36、质量管理体系文件-质量管理体系的测量、分析和改进程序;
37、质量管理体系文件-其他质量体系程序信息;
38、质量管理体系文件-质量管理体系核查文件。
结果样本

常见问题
问题:企业想申请优先注册,如果提交材料?
答:适用优先注册程序的申请在申报资料-申请表项下提交,需单独整理成一个文件,并命名为《优先注册申请材料》。在《监管信息-章节目录》中需注明《优先注册申请材料》的页码。(《辽宁省第二类医疗器械优先注册程序》https://ypjg.ln.gov.cn/ypjg/zwfw/ggtg/ylqx/0CC59FE5A7484FC6A7C39D6058279F29/index.shtml)
本办事指南摘自药监局官网,如有变动,以官方发布为准。