基本信息
1、办理部门:安徽省药品监督管理局
2、办理方式:网上办理、窗口办理
3、办理地点:安徽省合肥市包河区马鞍山路509号安徽省政务服务中心1号办事大厅企业开办综合窗口
4、咨询电话:0551-62999795、0551-62999882 CIO咨询:400-003-0818
受理条件
1. 申请人为安徽省内持有药品生产许可证的药品上市许可持有人;
2. 申请人应当符合《药品管理法》《疫苗管理法》等法律法规的要求;
3. 申请人应当符合《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》(2023年第132号)关于“严格委托生产的许可管理”等有关要求;
4. 申请材料(具体见申请材料目录)齐全、符合形式审查要求,或者申请人按照要求提交全部补正材料的,予以受理。
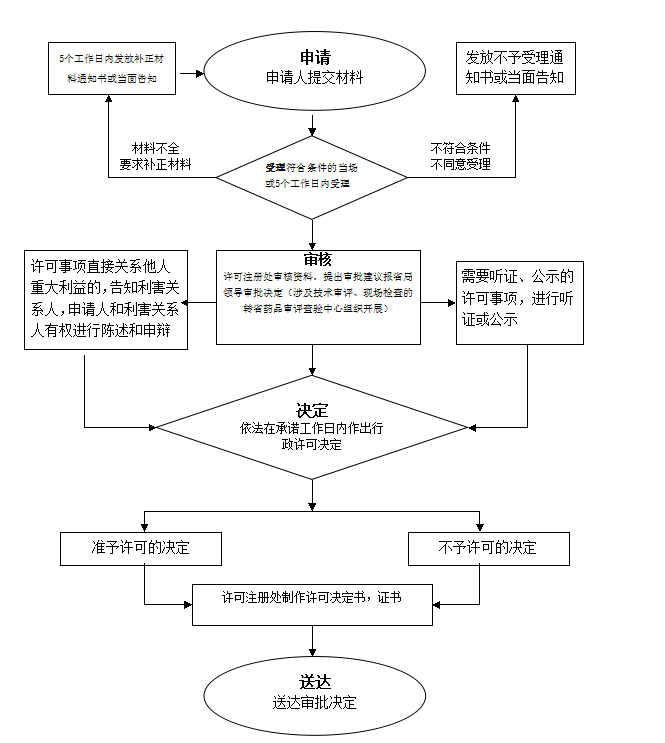
办理流程
流程文字说明
法定办理时限:15个工作日;承诺办理时限:12个工作日
1、受理(时限:1个工作日)
2、审查(时限:9个工作日)
3、决定(时限:1个工作日)
4、办结(时限:1个工作日)
申请材料
1、药品生产许可证变更申请表;>>安徽省药品生产许可证变更申请表
2、基本情况;
3、组织机构图;
4、关键人员情况等证明性材料;
5、技术人员登记表;
6、高级、中级、初级技术人员的比例情况表;
7、拟委托生产的情况;
8、拟委托生产剂型品种的工艺流程图;
9、生产管理质量管理主要文件目录;
10、药品上市放行规程;
11、持有人确认受托方具有受托生产条件技术水平质量管理能力的评估报告;
12、受托方药品生产许可证正副本;
13、委托协议质量协议;
14、受托方药品生产企业的情况说明;
15、受托方周边环境图平面布置图;
16、受托方生产工艺布局平面图、空气净化系统送风回风排风平面布置图、工艺设备平面布置图;
17、受托方确认验证校验情况;
18、受托方主要生产设备检验仪器目录;
19、受托方药品出厂放行规程;
20、受托方所在地省级药品监管部门出具的通过药品GMP符合性检查告知书;
21、受托方所在地省级药品监管部门出具的同意受托生产的意见;
22、申请材料全部内容真实性承诺书;
23、授权委托书;
24、药学研究资料。
结果样本


常见问题
问题1:药品转让过程中,仅持有人变更,生产场地、生产工艺等其他事项均未发生变更的,在持有人变更获得批准后是否需要通过GMP符合性检查?
答:变更后的持有人及药品生产企业均应满足药品生产质量管理规范的符合性检查要求,转让的药品在通过GMP符合性检查,符合产品放行要求后,方可上市销售。
问题2:已上市品种变更生产场地的,持有人需要开展研究、评估和必要的验证吗?
答:需要。
问题3:有关技术指导原则包括哪些?
答:《已上市化学药品药学变更研究技术指导原则(试行)》(2021年2月10日发布) 《已上市中药药学变更研究技术指导原则(试行)》(2021年4月2日发布) 《已上市生物制品药学变更研究技术指导原则(试行)》(2021年6月25日发布)。
问题4:中药饮片生产企业可以将中药饮片委托其他企业生产吗?
答:不能。
问题5:企业不能提供受托方所在地省局出具的同意受托生产的意见,能不能办理?
答:不能。
问题6:能否不按照《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》的要求进行办理?
答:不能。
本办事指南摘自药监局官网,如有变动,以官方发布为准。

























