以现场核查法规全流程为例讲解药品注册
CIO专家-爬山虎
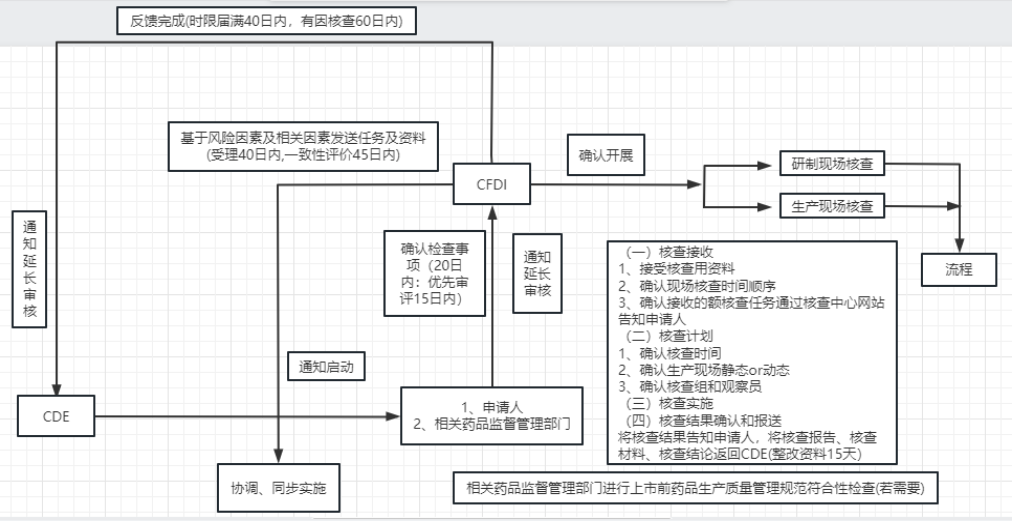
药品注册申请受理后,药品审评中心(CDE)在药品注册申请受理四十日内通知药品核查中心(CFDI)启动注册核查工作,以核实申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制的合规性、数据可靠性等。现在CIO小编对药品注册:注册现场核查流程、核查要点及内容进行总结归纳。
注册现场核查流程图
品种因素
高风险:
(一)化学药品创新药和改良型新药 ;
(二)中药创新药和改良型新药;
(三)生物制品(体外诊断试剂除外);
(四)中药注射剂;
(五)采用创新工艺或常规工艺中引入新技术的品种;
(六)其他药品审评中心认为应纳入高风险情形的品种。
中风险:
(一)脂质体、微球、微乳、长效或缓控释制剂、吸入制剂等复杂剂型的;
(二)合成多肽、多组分生化药品、处方中含有大毒药材的中药民族药等特殊品种的;
(三)采用非常规灭菌工艺,微片制备、干压包衣等复杂工艺的;
(四)其他药品审评中心认为应纳入中风险情形的品种。
低风险:除上述品种因素高、中风险情形,其他均为品种因素低风险情形。
研发生产主体合规因素
(一)新开办企业或既往无相关剂型生产经验的企业;
(二)支持药品上市的关键数据研究机构近三年未接受过国内外药品监管机构注册核查、监督检查的;
(三)药品生产企业(生产线和场地设施)、支持药品上市的关键数据研究机构等近三年有国内外药品监管机构注册核查、监督检查等不通过或发现真实性问题、重大缺陷或重大不合规问题的;
(四)药品生产企业(生产线和场地设施)、支持药品上市的关键数据研究机构等涉及近三年有因真实性问题注册申请审评不通过的,以及样品检验不合格的;
(五)药品生产企业(生产线和场地设施)、支持药品上市的关键数据研究机构等涉及近三年有接到注册核查通知后撤回药品注册申请的;
(六)临床项目研究机构之间(包括临床试验机构、中心实验室、生物样本分析测试机构、临床试验现场管理组织等,下同)或与申办方之间存在关联关系的;
(七)其他药品审评中心认为应考虑的研发生产主体合规因素。
备注:
原则上以品种因素和研发生产主体合规因素中风险情形较高的确定注册申请风险等级,特殊情况的除外。对于补充申请,生物制品和中药注射剂不纳入品种因素高风险情形。
研制现场核查内容
准备内容
1、药品研制基本情况(如属委托,应说明被委托研究单位基本情况)。
2、研制所涉及的批次(含BE批)批量用途,研制批次(含BE批)生产的地址、生产线、时间地点、使用量和剩余量等。
3、研制批次(含BE批)所用处方生产工艺、原辅料包装材料来源及标准、生产线(设备设施)、产品质量标准(含中间控制标准)等是否与已上市/拟上市商业化生产规模的批次一致。
4、参比制剂的来源、采购和使用情况。
5、药品和参比制剂体外研究的对比研究情况,研究时间、批号和研究结果。(质量对比和溶出曲线)
6、药品关键质量属性(含稳定性)研究情况。(全检数据及稳定性数据)
7、接受现场检查品种全套注册申报资料。
8、委托研究协议和质量协议,如有。
9、参比制剂的来源及证明,如购买发票、赠送证明等。参比制剂的包装标签、说明书、剩余样品等。参比制剂的接收、发放、使用记录或凭证。
10、药品相关研究记录,包括:处方工艺研究原始记录,如有;样品试制相关原始记录;质量研究相关原始记录;体外评价及稳定性研究的相关原始记录;仪器设备使用记录;纸质图谱及电子图谱。
11、其他相关文件,包括:处方药品检验方法确认或验证资料;稳定性试验方案及报告;体外研究总结报告;溶出度仪的验证资料;研究用的剩余样品情况(不应销毁)。
核查要点
1、组织机构与人员:研究内容相适应的管理机构,相应的质量管理;具有资质的人员。
2、研究条件:场地、设备、仪器和管理制度。
3、文件和记录:应当建立文件和记录管理的制度或标准操作规程。药物研究开发全过程应有相应记录,包括预试验和探索性研究的数据和记录。
4、变更和偏差管理:至少在药物进入临床阶段后就应当建立与药物研发阶段相适应的变更、偏差和失败管理制度或标准操作规程,针对关键批次出现的偏差或失败应当得到适当的调查和/或分析,并进行记录。
5、委托机构:
①、委托其他机构进行全部或部分药学研究及样品试制的,委托方应当对受托方的研究能力、质量管理体系等进行评估,以确证其研究条件和研究情况。
②、双方应当签订委托合同或其他有效证明。
③、委托方应当对委托研究的过程和结果负责,并确保委托研究过程中的数据可靠性。受托方应当遵守相关要求,保证研究及样品制备过程规范、数据真实可靠、研制过程可追溯。
判定标准(不合格情况):
1、发现真实性问题或申报资料真实性存疑,申请人不能证明其真实性的;
2、关键研究活动、数据缺少原始记录导致无法溯源的;
3、发现与申报资料不一致,可能影响质量评价的;
4、存在严重的数据可靠性问题,导致对药品安全性、有效性、质量可控性的评价产生影响的;
5、拒绝、不配合核查,导致无法继续进行现场核查的。
以上就是CIO小编为大家对药品注册:注册现场核查流程、核查要点及内容进行的总结归纳,希望对大家有所帮助。作为专业的第三方咨询服务公司,CIO合规保证组织为医药企业提供药品注册生产现场模拟检查服务,帮助企业做好迎检准备,顺利通过现场检查。有意向进行药品注册生产现场模拟检查服务的企业欢迎与我司咨询。
*以上文章仅代表作者个人观点
























