卫材阿尔茨海默症新药Lecanemab获得FDA顾问委员会全票通过
CIO专家-山丹
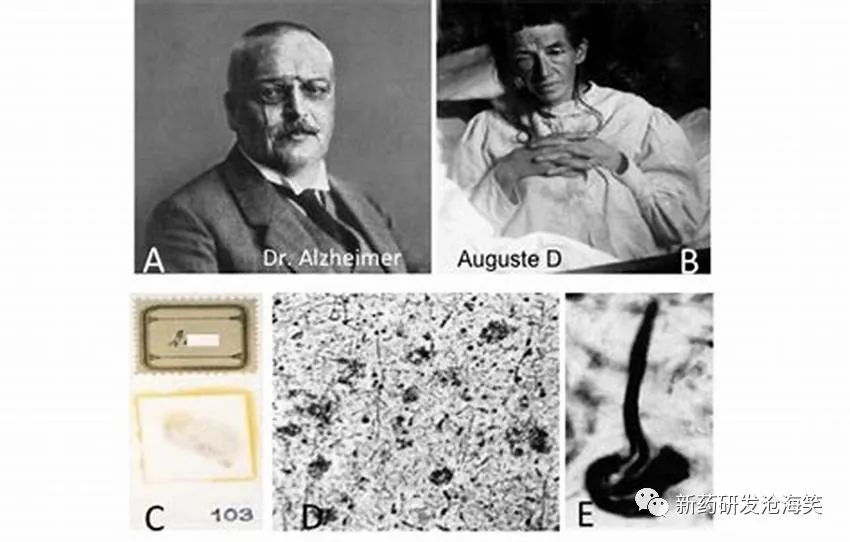
阿尔茨海默博士及其研究
前言
距离上一种阿尔茨海默病治疗药物获得FDA全面批准已经将近20年。Lecanemab是一种单克隆抗体,商品名Leqembi,是一种潜在的可以减缓认知功能衰退,痴呆疾病进展的药物。该药物并非治愈,而是通过与阿尔茨海默症的标志性特征之一-β淀粉样蛋白结合来发挥作用。
尽管II期临床出现某些严重不良事件(包括脑肿胀和出血),由于临床上有重大的未满足需求,FDA于今年1月加速批准了Leqembi用于轻度认知障碍或轻度痴呆患者。加速批准是提前批准治疗严重疾病并“填补医疗需求缺口”的药物,同时要求申办方及研究人员继续研究药物以确证其临床益处。如果这些确证性临床试验显示出临床获益,FDA可以对该药物授予传统的全面批准。但如果确认性研究未显示益处,该药物可能会被撤出市场。
顾问委员会对于lecanemab获益/风险的看法
6月9日,FDA的周围和中枢神经系统(PCNS)药物咨询委员会开会讨论了Eisai制药公司寻求全面批准的Lecanemab的确认性III期研究结果。最终,委员会成员以6-0的投票结果支持该药物的临床效益。预计FDA将于7月6日前做出决定。
“我认为有关临床效益的证据非常明确,非常有力,”马萨诸塞州综合医院的神经学主任、FDA咨询委员会成员梅丽特·库德科维奇博士在会议中说道。其他许多委员会成员也持类似观点。
数据还显示,在接受Lecanemab的参与者中,26%出现了输注相关反应,而接受安慰剂的参与者中只有7%出现了这种反应。在接受Lecanemab的群体中,有17%出现了脑出血,而安慰剂组中有9%出现了这种情况;有13%出现了脑水肿,而接受安慰剂的群体中只有2%出现了脑水肿。“这些反应往往发生在治疗早期,这支持了在治疗的前六个月进行监测,”Eisai的阿尔茨海默病和脑健康高级副总裁兼副首席临床官迈克尔·伊利扎里博士在周五告诉FDA委员会。
全球医疗咨询公司Numerof & Associates的管理合伙人迈克尔·阿布拉姆斯在周五的一封电子邮件中表示,副作用的潜在可能性可能会影响该药物的覆盖范围。虽然他未参与FDA咨询委员会的投票,但他一直密切关注有关Lecanemab的讨论。他说:“尽管在试验中,Leqembi使早期阿尔茨海默病患者的认知能力下降减缓了27%,但该治疗方法也存在严重的脑水肿和出血风险。”“这可能是CMS对其使用施加先决条件的原因,限制了有资格接受治疗的患者数量(至少在最初阶段),并减少该计划可能面临的50亿美元的成本。”
在先前的研究中,约6.9%接受Lecanemab的试验参与者因不良事件退出了试验,而接受安慰剂的参与者中有2.9%退出了试验。总体而言,接受Lecanemab的群体中有14%出现了严重不良事件,而安慰剂组中有11.3%出现了这种情况。Lecanemab组中最常见的不良事件是对静脉输注的反应和其MRI检查的异常,例如脑肿胀和出血,也被称为与淀粉样蛋白相关的影像异常(ARIA),可能会危及生命。FDA指出,药物的处方信息中有关于ARIA的警告。一些出现ARIA的人可能没有症状,但有时可能需要住院治疗或导致持久性损害。而且,ARIA的发生频率似乎在具有APOE4基因的人群中较高,该基因可能增加患阿尔茨海默病或其他痴呆症的风险。在APOE4非携带者中,“ARIA发生率较低”。FDA咨询委员会讨论了对APOE4携带者的Lecanemab整体风险与益处的担忧。“ARIA发生率相当高,”委员会成员、Neumora Therapeutics的首席医学官迈克尔·戈尔德医生表示。
根据阿尔茨海默病协会的数据,美国有超过650万人患有阿尔茨海默病,预计到2060年这一数字将增加到1380万。去年,CMS限制了有争议和昂贵的Aduhelm药物的覆盖范围,仅限于参加符合条件的临床试验的人群,这限制了能够接受该药物治疗的人数。以前,Medicare从未要求已经获得FDA批准并用于预期用途的药物的参与者参加临床试验。
如果lecanemab获得传统的FDA批准,这将是20年内首款。联邦医疗保险和医疗补助服务中心(CMS)表示将提供更广泛的覆盖范围,这意味着医疗保险患者可能会更容易获得该治疗药物。然而,覆盖范围将附带一些条件。CMS管理员Chiquita Brooks-LaSure在本月的一份声明中表示:”如果FDA授予传统批准,联邦医疗保险和医疗补助服务中心(CMS)准备确保符合条件的任何拥有医疗保险B部分(Medicare Part B)的人都可以获得覆盖。CMS将在医生和临床团队参与及协助下收集药物在真实世界也称为注册登记研究的证据,提供对批准药物的覆盖,证据提供者将能够通过CMS的协助门户提交证据。
然而,患者团体和制药行业对注册登记研究表示担忧,称其将成为治疗的一道障碍。“我们完全同意FDA咨询委员会的观点,即Leqembi具有临床益处,并且这种益处大于风险。现在所有的目光都转向联邦医疗保险和医疗补助服务中心(CMS),”阿尔茨海默病协会的总裁兼首席执行官乔安妮·派克博士在6月9日的一份声明中表示。“CMS应该是美国人的坚固保证,现在是CMS站出来,在FDA传统批准的当天提供医疗保险的时候了。患有阿尔茨海默病的美国人应该能够无障碍地获得FDA批准的疗法,就像患有癌症、心脏病和HIV/AIDS的人一样。”
专家表示,委员会对Lecanemab的支持是其寻求可能获得FDA全面批准的“重要里程碑”。“对Lecanemab的支持投票对于每个患有阿尔茨海默病的患者、每个有家人受到阿尔茨海默病影响的家庭,以及未来有患上阿尔茨海默病风险的每个人来说,都是一个重要的里程碑,”迈阿密大学健康系统UHealth的认知神经学首席和综合脑健康中心主任詹姆斯·加尔文博士在6月9日的一封电子邮件中表示。他未参与FDA委员会的会议。他写道:“距离上一种阿尔茨海默病治疗获得FDA全面批准已经将近20年,且从未有过一种疾病修复性药物获得FDA全面批准。”“今天的投票几乎可以确定将会有两个重要决定——FDA全面批准以及CMS同意以某种形式为治疗提供保险。这是一个关键问题,以确保来自各种社会和经济背景的所有患者都能获得药物。”
Lecanemab的确证性III期临床研究(B301)设计
1)研究设计
301研究是一项多中心、随机、双盲、安慰剂对照、平行组设计的研究,旨在评估lecanemab在轻度认知障碍(MCI)或轻度阿尔茨海默病(AD)痴呆患者中的疗效和安全性。该研究的主要目标是在治疗的18个月内,与安慰剂相比,lecanemab对基线时临床痴呆评定量表总分(CDR-SB)的改变是否具有优越性。
该研究包括60天的筛选期、为期18个月(78周)的安慰剂对照期以及最后一次剂量后为期3个月的安全随访期。在安慰剂对照期中,患者以1:1的比例随机分配到安慰剂组或每两周10 mg/kg的lecanemab组。研究入组北美、欧洲、澳大利亚和亚洲的13个国家共235个中心的受试者。
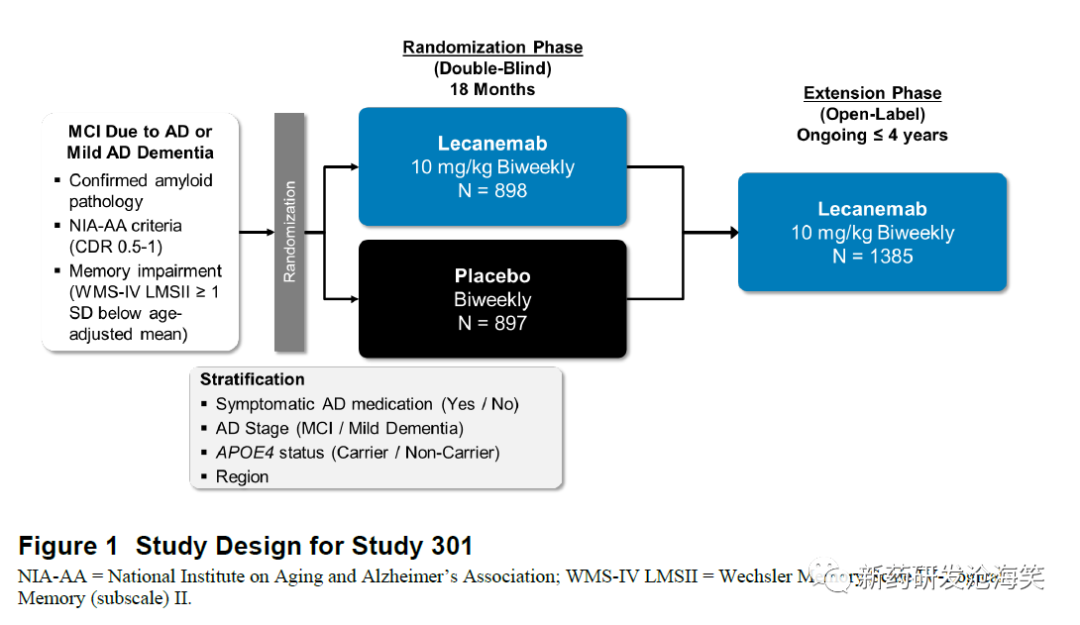
2)人群
患者符合2011年国家老龄化研究所-阿尔茨海默病协会(NIA-AA)框架6,7定义的AD引起的MCI或轻度AD痴呆的临床标准,并且需要通过PET的或CSF评估的t-tau/Aβ1-42来证明存在脑部Aβ病理学证据。患者基线时的MMSE)评分为22到30分(包括22和30),CDR总体评分为0.5或1.0,memory box评分为0.5或更高。
随机化分层依据临床亚组(AD引起的MCI或轻度AD痴呆)、ApoE ε4携带者状态(携带者或非携带者)、同时接受AD治疗的其他药物治疗(是或否)以及地理区域(北美、欧洲或亚太地区)。至少有50%的入组患者应属于AD引起的MCI亚组。
3)研究终点
主要疗效终点:
主要疗效终点是第79周时与基线相比的CDR-SB变化。CDR-SB评估了认知的三个领域(记忆、定向、判断/问题解决)和功能的三个领域(社区事务、家庭/爱好、个人护理)。每个领域的分数相加得出CDR-SB值,范围从0到18,较高的分数表示疾病严重程度更高。CDR-SB被FDA接受作为AD研究中评估疗效的主要结局指标,旨在证明充分的有效性证据。CDR-SB评估由未参与患者护理或管理的临床医生进行,该医生对安全评估结果保持盲视。要求所有研究点在整个研究期间保持同一评定者。
次要临床疗效终点:
阿尔茨海默病评估量表-认知亚量表(ADAS-Cog)。ADAS-Cog是一种认知评估,包括临床和测量记忆、语言和动作障碍的认知任务。该量表范围从0到90,较高的分数表示疾病严重程度更高。
阿尔茨海默病合作研究-用于轻度认知功能障碍的日常生活活动量表(ADCS-ADL-MCI)。ADCS-ADL-MCI是一份针对知情人的问卷,包括17个工具性项目和1个基本项目(穿衣),旨在反映日常生活活动。总分范围从0到53,较低的分数表示功能受损程度更高。
阿尔茨海默病综合评分(ADCOMS)。ADCOMS是从三个常用量表中选择的项目加权线性组合:来自ADAS-Cog的4个项目,来自MMSE的2个项目,以及来自CDR-SB的全部6个项目。ADCOMS分数范围从0到1.97,较高的综合分数表示疾病严重程度更高。
4)统计分析计划
统计分析计划(SAP)于2019年4月9日发布,并进行了一次修订,在研究完成前于2022年9月6日实施最终版本。
使用MMRM模型分析基线到18个月CDR-SB的变化,将基线CDR-SB作为协变量,并将治疗组、访视次数、临床亚组(MCI或轻度AD痴呆)、基线时是否使用AD药物(是或否)、ApoE ε4携带者状态(携带者或非携带者)、地理区域(北美、欧洲或亚太地区)、基线CDR-SB-按访视次数以及治疗组-按访视次数的交互作为固定效应。分析中包括所有观察到的数据,包括在发生并发事件后收集的数据。
每个统计检验的显著性水平为双侧α = 0.05。仅在前一个检验具有统计学意义时,才对次要终点进行检验。关键次要终点按照以下顺序进行检验:(1)18个月时基线到淀粉样PET(Centiloids)的变化,(2)18个月时基线到ADAS-Cog 14的变化,(3)18个月时基线到ADCOMS的变化,以及(4)18个月时基线到ADCS-ADL-MCI的变化。
根据监管机构的要求,申请人为主要疗效分析定义了两个人群:欧洲和日本监管机构的ITT完整分析集(FAS+),以及FDA和其他全球监管机构的ITT FDA完整分析集(ITT FDA FAS)。FAS+包括接受至少一剂研究药物的随机患者,且具有基线评估和至少一个剂后主要疗效测量。为了解决COVID-19大流行可能导致的漏服剂量的问题,FDA FAS与FAS+类似,但排除了在剂量暂停结束日期之前或者当日随机分配的患者,在这些研究中,剂量暂停持续了6周或更长时间(相当于连续3次剂量)。
Lecanemab确证性III期研究(B301)结果
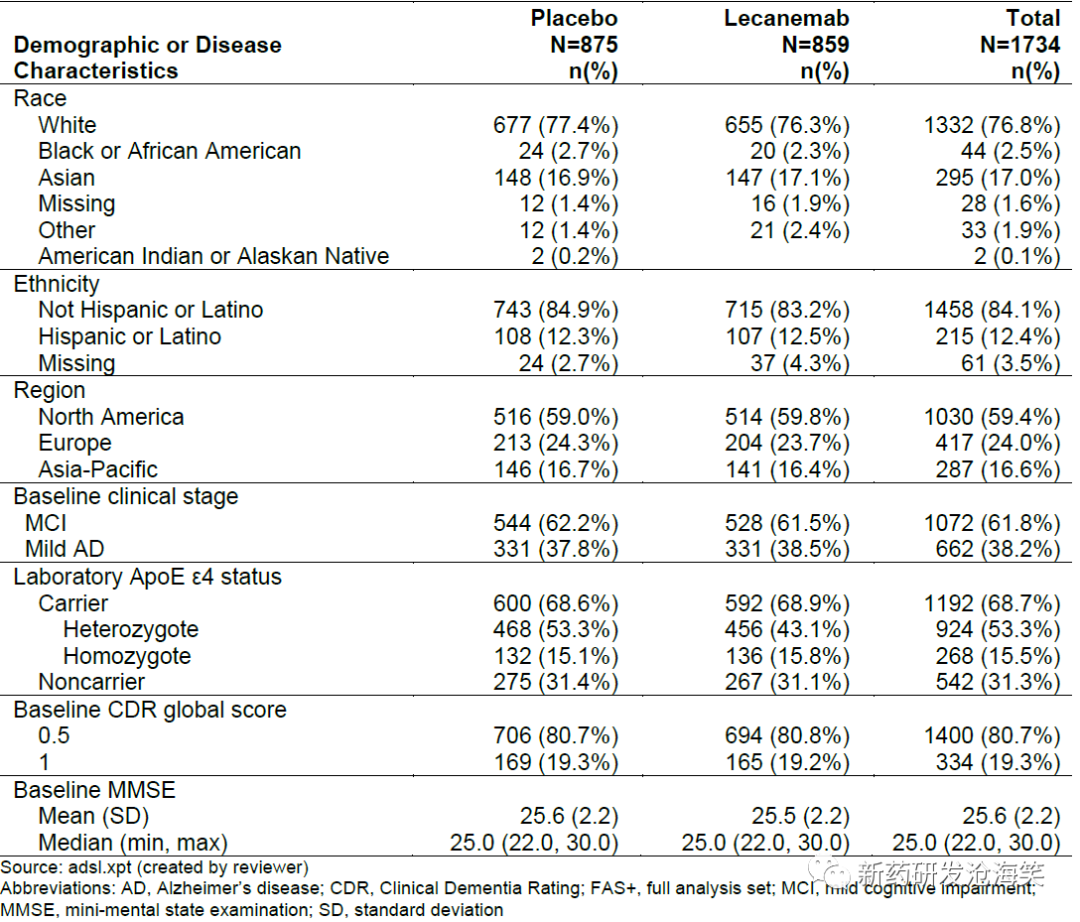
1)受试者分布、人口统计学及基线特征
研究筛选5967名患者,其中1795名患者随机分组。筛选失败的最常见原因是未达到纳入或排除标准。所有被随机分组的患者至少接受了一剂研究药物。在1795名被随机分组的患者中,接受安慰剂治疗的140名患者(15.6%)和接受lecanemab治疗的169名患者(18.8%)退出了研究。两组退出研究的原因分布相似,但lecanemab治疗组有更多患者因不良事件而退出研究(5.7%),相比之下,安慰剂组的比例为3.1%。只有16名患者因与COVID-19相关的原因退出了研究。由于COVID-19大流行期间研究药物的中断,申请人定义了FDA FAS分析集,目的是排除可能错过连续lecanemab剂量的患者。与FAS+人群相比,共有来自19个研究中心68名患者被排除(其中lecanemab治疗组26人,安慰剂组42人)。在被排除的lecanemab治疗组患者中,有16人没有因COVID-19而错过任何剂量,仅有3人因COVID-19而错过了3剂或更多剂量。
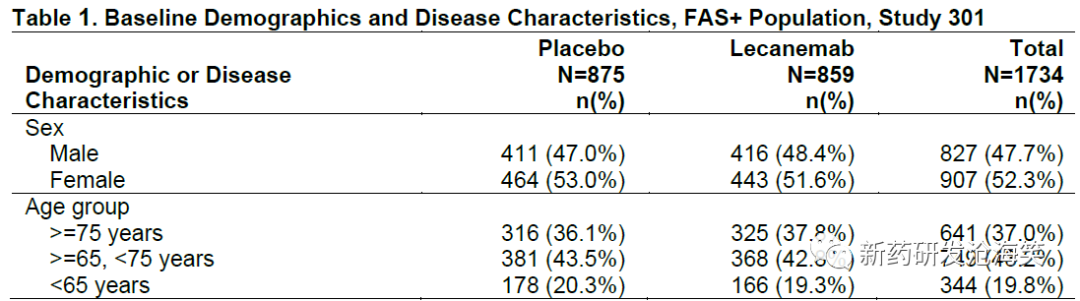
基线人口学和疾病特征在治疗组之间基本平衡(见下表),反映了早期阿尔茨海默病患者的人群的特征。总体上,FAS+人群中有52%的患者来自美国。大多数患者(53%)正在接受与阿尔茨海默病相关的伴随治疗药物,3%的患者报告曾接受过阿尔茨海默病药物治疗。
2)有效性结果
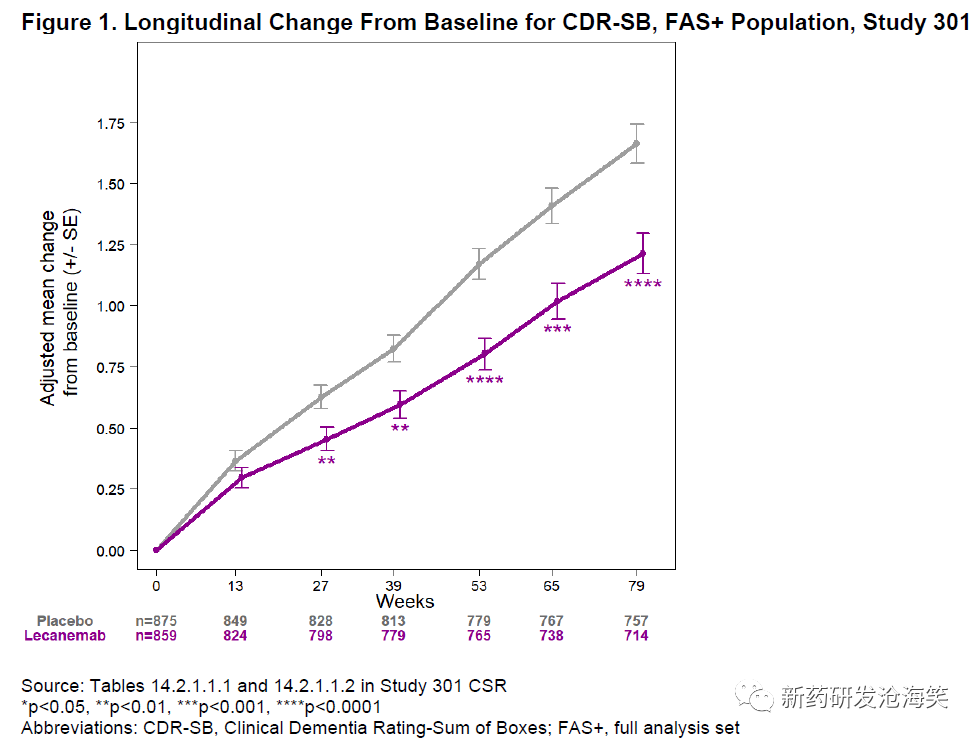
主要疗效终点结果:
主要终点是第79周时与基线相比CDR-SB的变化,结果显示在FAS+人群中,lecanemab治疗组与安慰剂组相比具有显著差别(-0.45[-27%],p=0.00005)(见下表),并且在FDA FAS人群中也具有统计学意义的治疗效果(-0.39[-25%],p=0.0004)。在第27周时就达到了名义上的统计学显著性,并且在第79周时仍然保持。


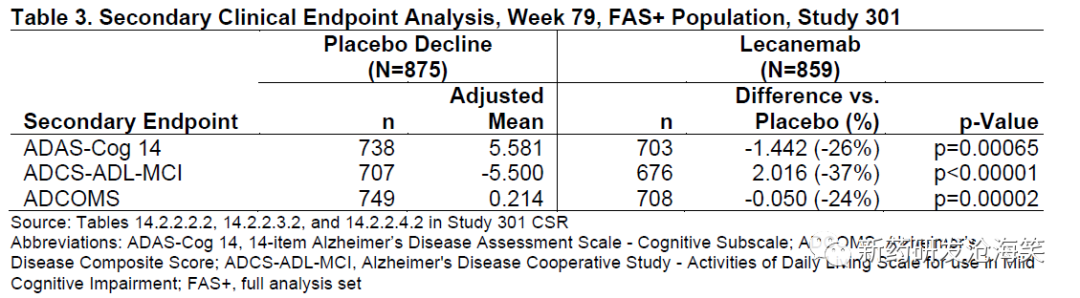
次要疗效终点结果:
次要临床终点分析结果显示,lecanemab的统计学显著结果。与安慰剂相比,lecanemab在ADAS-Cog 14(-1.442[-26%],p=0.00065)、ADCS-ADL-MCI(2.016[-37%],p<0.00001)和ADCOMS(-0.050[-24%],p=0.00002)上的变化从基线减少。在FDA FAS分析集中也观察到类似大小的统计学显著结果。结果在敏感性分析中表现稳健。所有次要临床终点在第27周达到统计学显著性,并在第79周保持不变。
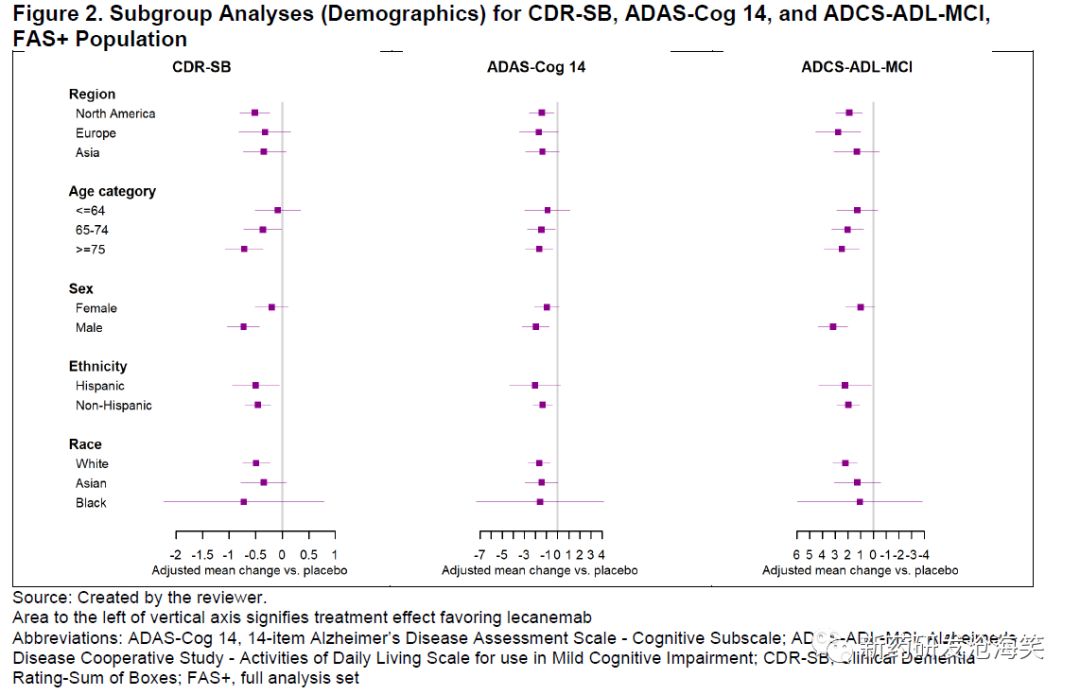
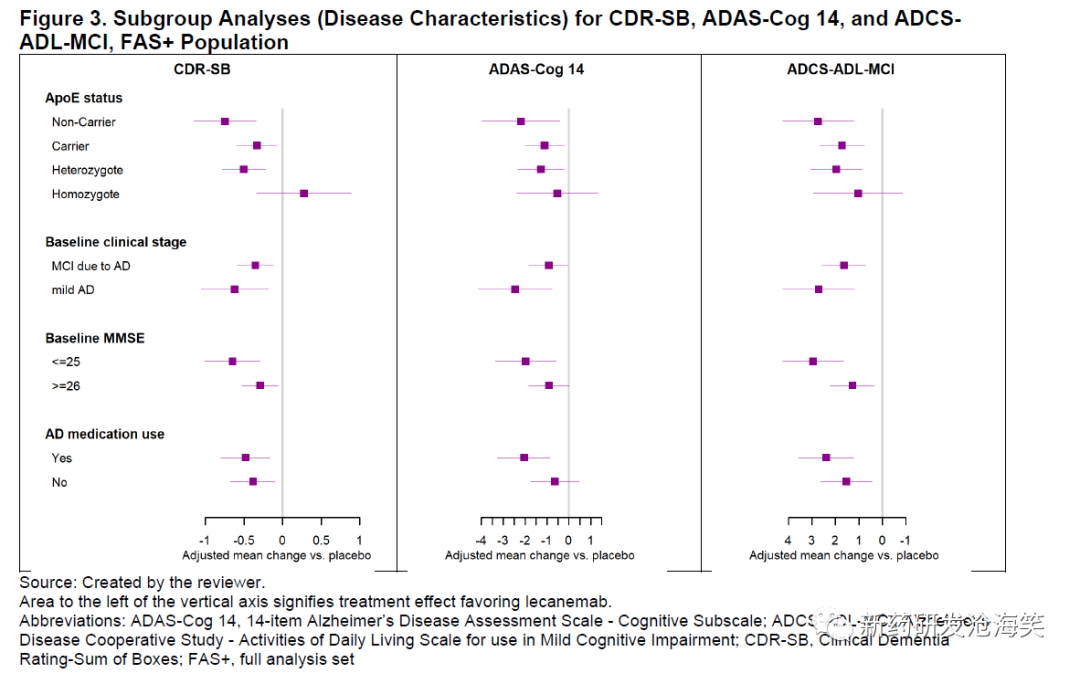
亚组分析
对人口统计学特征(下图)和基线特征(下图)进行了预先规定的亚组分析。除了ApoE ε4纯合子患者的CDR-SB基线变化外,所有亚组分析都有利于lecanemab组,包括3个不同的临床终点。值得注意的是,ApoE ε4纯合子亚组是预先规定的最小亚组之一,在安慰剂组和lecanemab组分别有132和136名患者。此外,ADAS-Cog 14和ADCS-ADL-MCI在该亚组中的结果也有利于lecanemab。在其他研究中观察到CDR-SB和ADAS-Cog 14以及ADCS-ADL-MCI之间的不一致结果。同样,纯合子携带者的健康结果测量和生物标志物的结果与整体人群的结果一致,并支持治疗效果。最后,在其他抗淀粉样病理治疗的临床试验中,并未始终观察到ApoE ε4携带者相对于非携带者的治疗反应减弱。
探索性终点
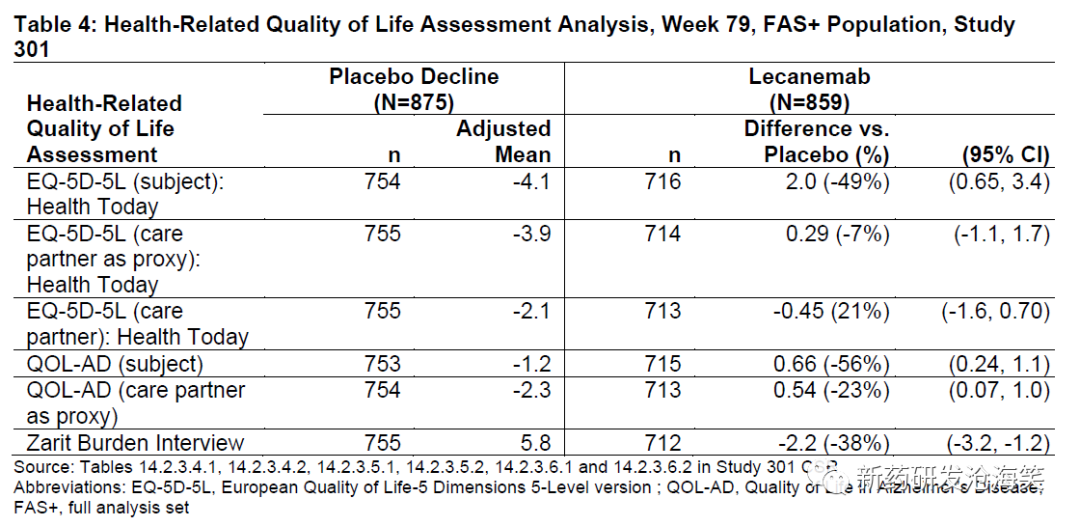
与安慰剂相比,lecanemab治疗与EQ-5D-5L和QOL-AD总评分的下降减少,以及Zarit负担面谈总评分的增加减少相关联(下表)。对于EQ-5D-5L的照顾伙伴评分或以照顾伙伴为代理的评分未观察到治疗效果。
影像学终点
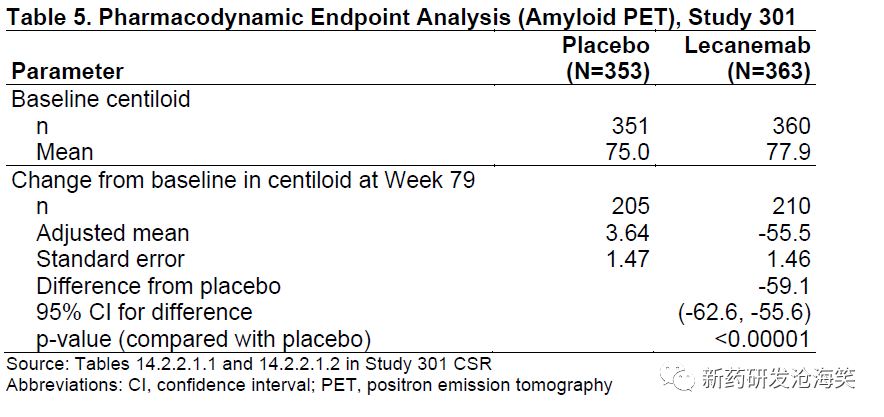
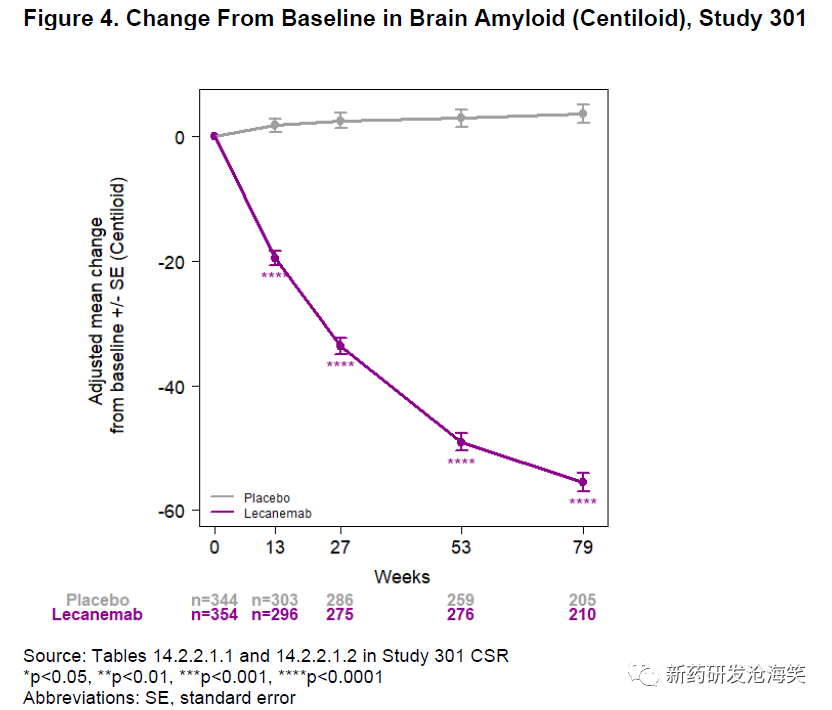
整体人群中对40%的患者(安慰剂组353名患者和lecanemab治疗组363名患者)进行了淀粉样PET评估。与基线相比,lecanemab治疗79周的脑淀粉PET测量显示出的显著的治疗效果,以Centiloids报告为单位(-59.1,p<0.00001)(表5),存在时间依赖关系(图4)。lecanemab治疗组患者在第79周的Centiloid中位数[第25-75百分位数]值为16.5 [3.8-37.3]。
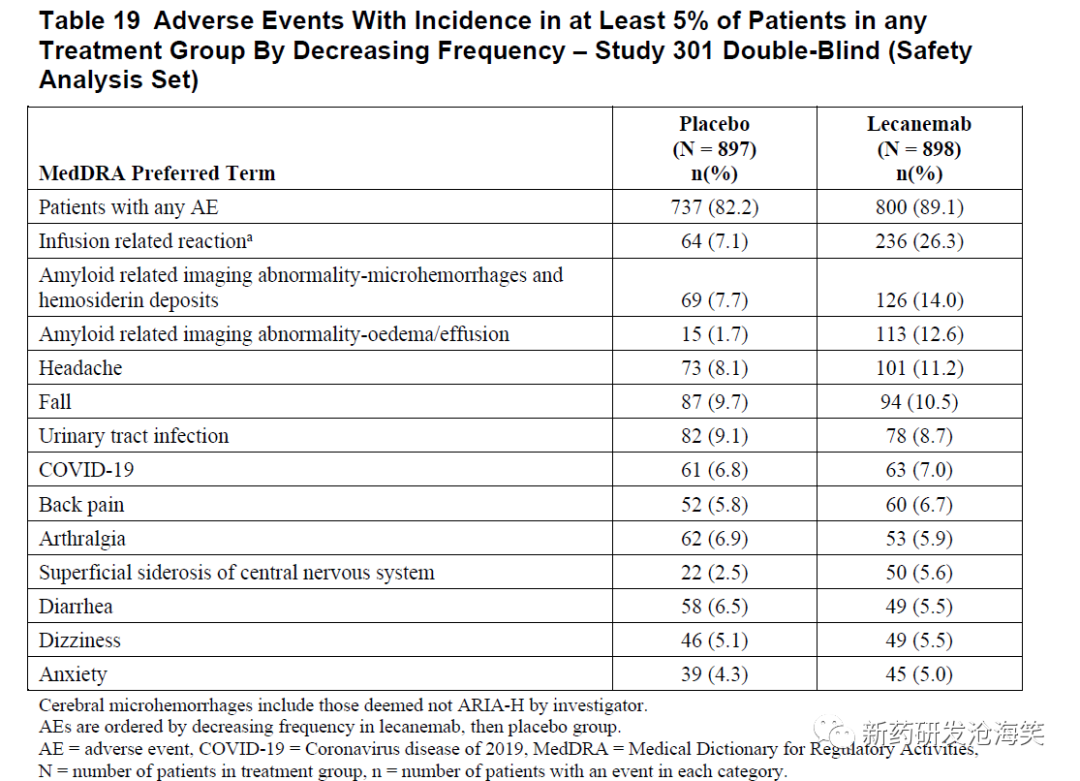
3)安全性结果
在301研究中,不良事件(AE)的总体发生率在安慰剂组(82.2%)低于lecanemab组(89.1%)。最常见(≥5%)的不良事件的发生率包括:
输注相关反应:安慰剂组7.1%,lecanemab组26.3%
淀粉样相关成像异常-微出血和铁血素沉积(脑微出血的首选术语):安慰剂组7.7%,lecanemab组14.0%,与暴露调整后的发生率(患者年)为安慰剂组0.06,lecanemab组0.11
ARIA-E:安慰剂组1.7%,lecanemab组12.6%。总体上,有2.8%的患者报告有症状性的ARIA-E。
头痛:安慰剂组8.1%,lecanemab组11.2%。
参考资料:
1.UPDATED INFORMATION: June 9, 2023: Meeting of the Peripheral and Central Nervous System Drugs Advisory Committee Meeting Announcement - 06/09/2023 | FDA
2.FDA advisers vote that lecanemab shows benefit as an Alzheimer’s treatment. CNN.Jun.09.2023.
*本文转载自微信公众号 - - 新药研发沧海笑
相关文件下载、服务及学习课程:
合规文库:美国联邦食品,药品及化妆品法(FC&C法)(FDA)
合规培训:FDA警告信分析及审计缺陷项纠正预防措施的制定(一)
委托定制:药品注册申请办理
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






