中药饮片新规,或将影响50万药企
CIO专家-苁蓉
5月国家药品监督管理局发布《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》(以下简称条例征求意见稿),该征求意见稿一经发出引发了医药行人士的热烈讨论,其中涉及中药饮片的新规变化较大。根据搜索数据显示,我国共有关键词为“中药饮片”的现存企业50.57万家。
中药饮片跨省销售
中药饮片跨省销售是否合规,争论一直持续至今,法规仍未有定论,主要《药品管理法实施条例》《药品流通监督管理办法》中没有禁止中药饮片生产企业依照本省中药饮片炮制规范生产的中药饮片向其他省份销售的规定。根据“法无禁止皆可为”原则,中药饮片生产企业对国家药品标准没有规定的,按照经国务院药品监督管理部门备案的当地省级炮制规范生产的合格中药饮片可以在省内外销售
但是近几年类似案件频发,部分案件由法院审理被判定为劣药,其理由是地方行政法规的法律效应范围,按照本省、市炮制规范生产的药品跨省销售,其生产企业所在省、市炮制规范的法律效应仅限于本省。这一点在地方性炮制规范中有载明,例如湖南省《中药饮片炮制规范》2010版在凡例中就有相应的描述:本规范是湖南省中药饮片生产、经营、使用、检验以及监督管理的法定依据。

而执行地方标准的饮片可以跨省销售,主要是以监管部门在互动交流板块答复。
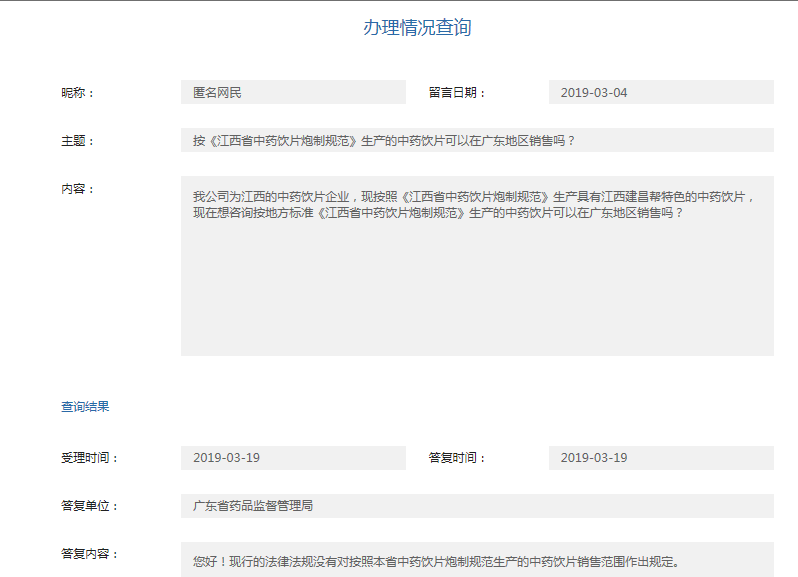
全国大部分省、市基本已明确回复执行地方标准的中药饮片可以跨省销售。内蒙古自治区,山东省,四川省,云南省四省暂未全面放开执行地方标准的中药饮片销售。
主要是参照原国家食药监局《关于中药饮片炮制规范适用范围的复函》(食药监注函〔2010〕46号)(备注:给予浙江省食药监局的复函)中明确了“各省、自治区、直辖市药品监管部门制定、颁布的中药饮片炮制规范仅适用于本辖区内中药饮片的生产、销售和检验等。”
5月发布《条例征求意见稿》对中药饮片跨省销售提出了两种方案,方案一是应当向销售使用地药品监督管理部门备案,方案二是应当向销售使用地药品监督管理部门批准;两种方案虽然只有细微的差别,但备案和批准需要执行的流程及时限是不一致的,备案只需要提交合格资料,相对较为宽松,可以确定的是跨省销售均需要获得销售使用地药品监督管理部门相关手续,较当前的全面放开政策有所收紧。个中细节还仍待完善,例如:备案或批准以何种形式向公众展示,方便公众查询呢?是备案和批准并行,还是地方药监部门自行制定规则?
中药饮片不得委托生产
中药饮片是否可以委托生产也是近年大家讨论比较激烈的一个话题,根据2019年12月1日实施的新修订的《药品管理法》中,明确“建立中药饮片质量追溯体系,对中药饮片生产、销售实行全过程管理,保证中药饮片安全、有效、可追溯”,但其中未明令禁止中药饮片委托生产。
同时《药品委托生产监督管理规定》第三条和第六条,明确了委托生产的定义:将其持有药品批准文号的药品委托其他药品生产企业(以下称受托方)全部生产的行为,关键在于是否取得批准文号。据笔者所知当前中药饮片均未实行批准文号管理,也就无法开展委托生产。
笔者了解到先后有湖北、山东、河北、安徽、四川、湖南6个省份发文开始试点中药饮片委托生产。
2020年3月,安徽省药监局发布了《安徽省药品监督管理局关于印发服务安徽省药品医疗器械产业高质量发展的若干措施的通知》。其中,明确表示同一园区内同一集团公司的药械生产企业,可以共用检测仪器设备。这里指的是药械生产企业,包含中药饮片企业。在临泉县开展试点工作。
虽然只是小规模、少品种、指定企业、部分工序的试点,但委托生产可以调动产能,充分发挥市场经济,促进就业。
中药饮片生产乱象频发,根据国家药品抽检年报(2021)中药饮片主要问题有:一是混伪品代用、掺杂问题,如藏柴胡冒充柴胡、关苍术及杂交苍术掺伪冒充苍术、苋菜子掺伪青葙子等;二是外源性有害物质残留超限问题,部分原料存在真菌毒素污染、农药残留污染、重金属及有害元素超标等隐患;三是采收加工与加工炮制不规范问题,柴胡饮片加工过程中地上茎过多导致非药用部位杂质超标。这些问题将影响患者用药安全,但由于专业性,普通人很难进行鉴别。
2022年4月国家召开药品安全专项整治中药相关工作推进会明确,加强中药质量安全监管。着力强化中药饮片质量监管,督促生产企业对中药饮片实行全过程管理,不得委托生产。在中药饮片质量监管不断的完善下,中药饮片生产企业应提高质量控制意识,严格遵照质量标准及炮制规范要求执行。
(以上仅代表作者个人观点)
如果您有《药品生产许可证》申请需求,点击下方联系我们。
相关文件下载、服务及学习课程:
合规文库:中药饮片经营管理制度-零售模板
合规培训:中药材、中药饮片经营管理
合规服务:药品生产许可证A证核发申请
联系专家,获取专家指导意见:e邀专家
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。







