药物警戒全面部署,《药品不良反应/事件报告表》如何填写?
CIO专家-燕窝
根据《药品不良反应报告和监测管理办法》第十九条规定,药品生产、经营企业和医疗机构应当主动收集药品不良反应,获知或者发现药品不良反应后应当详细记录、分析和处理,填写《药品不良反应/事件报告表》并报告。药物警戒贯穿于整个药物全生命周期管理,我们在日常药物警戒活动中,经常需要和《药品不良反应/事件报告表》打交道,那么《药品不良反应/事件报告表》在填写的时候有哪些注意事项呢?
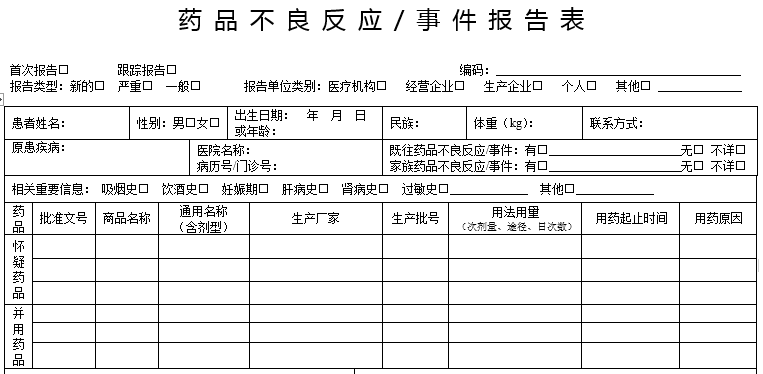
1.电子报表中的内容必须填写齐全和确切,不缺项。
2.在填写“怀疑药品”时,应填写你认为可能引起不良反应的所有药品,将这些药品的情况同时填上。药品名称需要填写通用名(即包装上所用的名称)和商品名,生产厂家要求填写全名,同时,一定要注明批号,用法(口服、肌注、静脉滴注或静脉注射)、用量准确明确。
3.填写“并用药品”时,主要填写可能与不良反应有关的同时并用的药品。
4.填写“用药起止时间”时,需要明确这里是指药品同一剂量的起止时间,用药过程中剂量改变时应另行填写或在备注栏中注明。
5.“用药原因”是很多人在填写的时候最容易犯错的一个点。需要注意这里的用药原因是用可疑药品的原因,不需要把患者所有病都列上。比如患者是因为卵巢囊肿同时合并肺部感染,注射了头孢曲松引起不良反应,那“用药原因”就填肺部感染,而不是卵巢囊肿。
6.在对“不良反应/事件过程描述”的时候要详尽、具体,描述包括临床表现和体征等。比如在描述过敏性皮疹时,需要描述皮疹的类型、性质、部位、面积大小等。是疱疹、丘疹还是斑疹?是痒还是不痒……这里需要注意的是,我们无需去描述患者的原有疾病。比如患者是因为扁桃体炎用头孢拉定出了皮疹,我们无需描述扁桃体炎,只需描述皮疹即可。
7.“不良反应/事件的结果”,是指本次药品不良反应经采取相应的医疗措施后的结果,不是指原患疾病的结果。
8.“关联性评价”,评价结果、报告人的职业和签名、日期均须填写齐全。
以上就是关于《药品不良反应/事件报告表》的填写要求了,如果还有疑问,欢迎点击下方的“e邀专家”,联系专家一对一咨询。CIO合规保证组织,为医药行业从业者提供一站式合规服务。
相关文件下载、服务及学习课程:
合规服务:建立药物警戒体系
连线专家:e邀专家






















