基本信息
1、办理部门:上海市药品监督管理局
2、办理方式:窗口办理,网上办理
3、办理地点:上海市徐汇区虹梅路街道宜山路728号3号楼底楼大厅上海市药品监督管理局行政服务中心1-5号窗口
4、咨询电话:021-63269368 CIO咨询:400-003-0818
受理条件
申报符合形式审查要求,或者申请人按照要求提交全部补充资料。
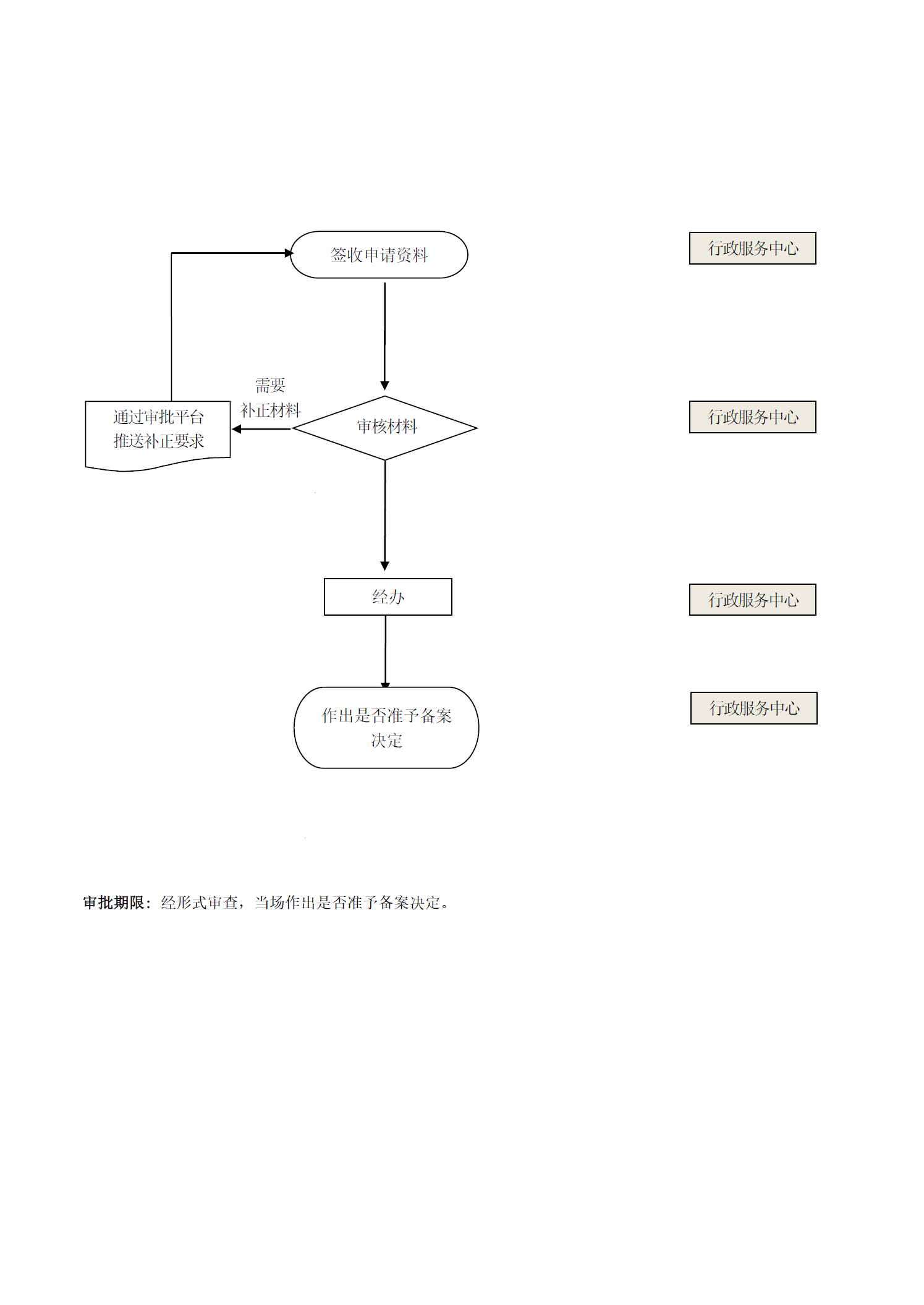
办理流程
流程文字说明
法定办结时限:当场办结;承诺办结时限:当场办结
1、收件与受理:0个工作日。
办理结果:市药监局行政服务中心接收申请人提交申请的材料(需在“一网通办”平台中填报信息并按规定上报相关电子材料,无需递交纸质资料)。
2、审查与决定:当场办结。
办理结果:经形式审查,当场作出是否准予备案决定,并在10个工作日内制作《医疗器械变更注册(备案)文件》。
3、颁证与送达:10个工作日。
办理结果:加盖电子签章的《医疗器械变更注册(备案)文件》通过企业申报端口推送至行政相对人。
申请材料
1、备案表(包含符合性声明、注册人关于变更情况的说明);>>申请表
2、企业营业执照副本或事业单位法人证书;
3、原医疗器械注册证及其附件、历次医疗器械变更注册(备案)文件及其附件;
4、根据产品具体变更情况提供相应文件。
结果样本

常见问题
问题1:医疗器械定义是什么?
答:医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:(一)疾病的诊断、预防、监护、治疗或者缓解;(二)损伤的诊断、监护、治疗、缓解或者功能补偿;(三)生理结构或者生理过程的检验、替代、调节或者支持;(四)生命的支持或者维持;(五)妊娠控制;(六)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
问题2:按医疗器械管理的体外诊断试剂有哪些?
答:按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品,可以单独使用,也可以与仪器、器具、设备或者系统组合使用。按照药品管理的用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂不属于本办法管理范围。
本办事指南摘自药监局官网,如有变动,以官方发布为准。