基本信息
1. 办理部门:浙江省药品监督管理局
2. 办理方式:网上申请,现场窗口申请,邮寄申请
3. 办理地点:浙江省杭州市莫干山路文北巷27号一楼受理大厅1、2号窗口
4. 药监咨询:0571-88903246 CIO咨询:400-003-0818
受理条件
(一)产品已取得医疗器械注册证并在有效期内;
(二)医疗器械说明书的变更内容不涉及注册变更的。
办理流程
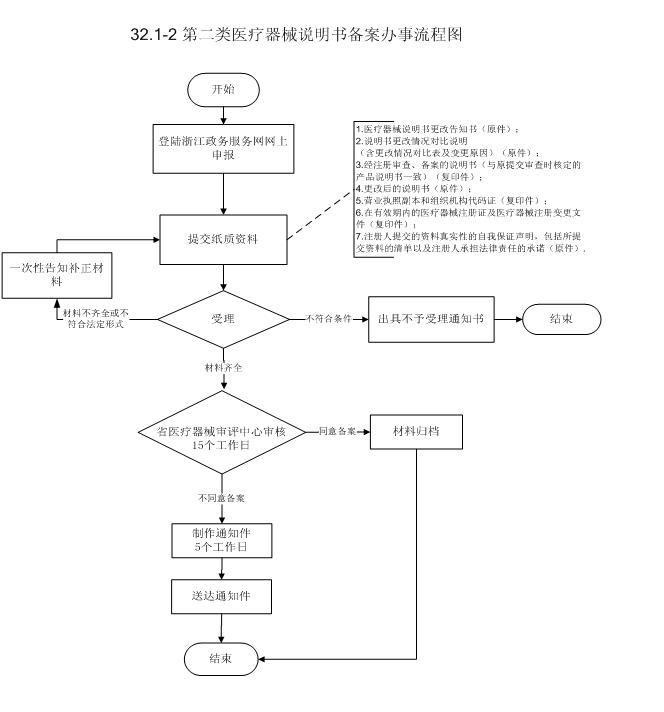
流程文字说明
1、申请
申请人通过省政务服务网网上申报,并提交相关电子申请材料。申请人按照申报资料要求,提供一套纸质材料,通过邮寄或直接递交,或者委托相关人员递交省药品监督管理局受理大厅。
2、受理(时限:1个工作日(不含材料补正时间))
办理结果:(1)申请事项依法不属于本行政机关职权范围的出具不予受理通知书。
(2)材料不齐全或者不符合法定形式,一次性告知补正的全部材料,送达《补正申请材料通知书》。
(3)申请材料齐全并且符合法定形式,予以受理并送达《受理通知书》。
3、审查和决定(时限:8个工作日)
办理结果:受理后,受理大厅将申报材料移交省医疗器械审评中心,中心根据法律法规和相关规定进行审查,在8个工作日内作出决定(同意备案的进行材料归档;不同意备案的制作通知件送达申请人)。
4、送达(时限:10个工作日)
办理结果:送达审批文件。
申请材料
1、第二类医疗器械说明书备案表。
常见问题
问题1:第二类医疗器械说明说明书备案适用体外诊断试剂吗?
答:不适用,体外诊断试剂说明书内容发生变化,应申报许可事项变更。
本办事指南摘自药监局官网,如有变动,以官方发布为准。