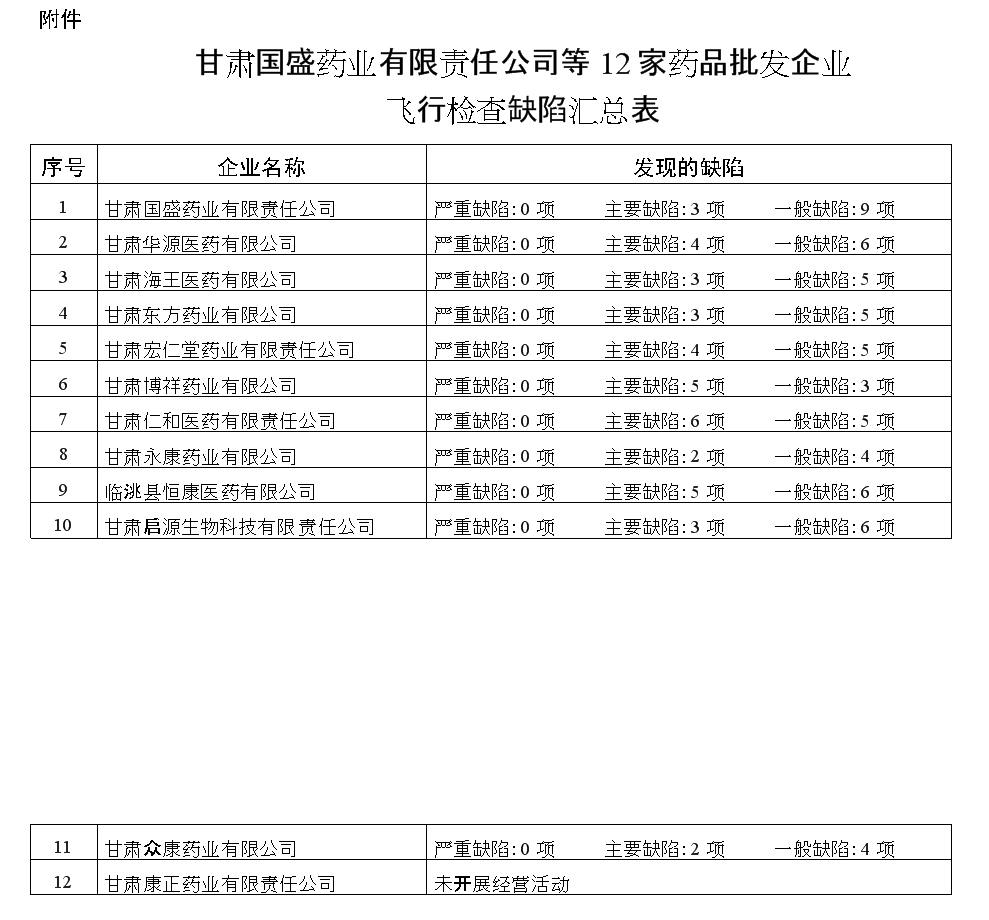
甘肃省药品监督管理局关于对甘肃国盛药业有限责任公司等12家药品批发企业飞行检查的通报
监管动态 企业 甘肃省
为贯彻药品管理相关法律法规要求,强化企业主体责任和地方政府监管责任落实,持续保持对药品流通领域违法违规行为高压严打态势,防范化解药品安全风险隐患。按照年度工作安排和工作计划,依据《药品医疗器械飞行检查办法》,我局组织12个飞行检查组,按照《药品管理法》《药品管理法实施条例》《药品流通监督管理办法》《药品经营量管理规范》及5个附录的相关规定,于10月29至31日对甘肃国盛药业有限责任公司等12家药品批发企业进行了飞行检查。
一、飞行检查发现的主要问题
(一)企业质量体系文件修订不及时。新修订《药品管理法》实施后,部分企业未及时修订质量体系管理文件,未组织开展内审,普遍存在企业质量管理体系执行力弱的问题。
(二)人员与培训教育和考核不到位。部分企业对人员法律法规专业知识培训教育考核不到位,少数企业特殊药品管理人员未进行相关法律法规知识和专业知识培训。
(三)设施与设备维护保养不深入。部分企业温湿度调控设备维护保养不到位;储存、运输设备未定期检查、清洁和维护,设施设备档案不完整。
(四)校准与验证不全面。部分企业未做极冷极热及停用超时限验证,个别企业验证报告未审核、未批准、未签字。
(五)计算机系统管理不到位。部分企业计算机系统对部分岗位应具备拦截的功能未实现;个别企业存在计算机数据能篡改的风险。
(六)药品验收工作不细致。部分企业与供货单位签订的质量保证协议存在未签字,内容不全的问题;对外包装破损的整件药品未检查验收至最小包装单元。
(七)药品储存与养护管理不精细。部分企业库房温湿度超标未采取有效措施进行调控,避光、遮光药品未按要求存放,特殊管理的药品未按照相关要求储存。
二、监督管理措施
(一)检查结果判定。从此次飞行检查总体情况看,未发现12家被检查企业存在违反《药品经营量管理规范》的严重缺陷,但都不同程度存在问题和缺陷,依据《药品经营质量管理规范现场检查指导原则》对检查结果的判定,对此次飞行检查的12家被检查企业,检查结果均为限期整改。
(二)后续处置。被检查企业应针对本次飞行检查所发现的问题和缺陷,分析研判原因,评估安全风险,采取必要管控措施,进一步落实质量安全主体责任;被检查企业所在地监管部门要监督相关企业进行问题整改,按照“五不放过”原则确保整改到位。同时,要按照信用管理、分级管理等有关规定,适当调整相关企业监管等级并按规定加强日常监管,及时纠正企业存在的问题缺陷,防范化解药品安全风险隐患。
目前12家被检查企业均按时完成了整改。
附件: 甘肃国盛药业有限责任公司等12家药品批发企业飞行检查缺陷汇总表.doc
附件