乘风破浪的基因治疗产品,商业化所面临的挑战
CIO专家-元参
一、基因治疗产品行业
基因治疗已经迈入快速增长的黄金时代。目前,基因治疗产品行业可以分为上游试剂耗材及设备、中游CDMO服务商,下游基因治疗技术研发三大块。
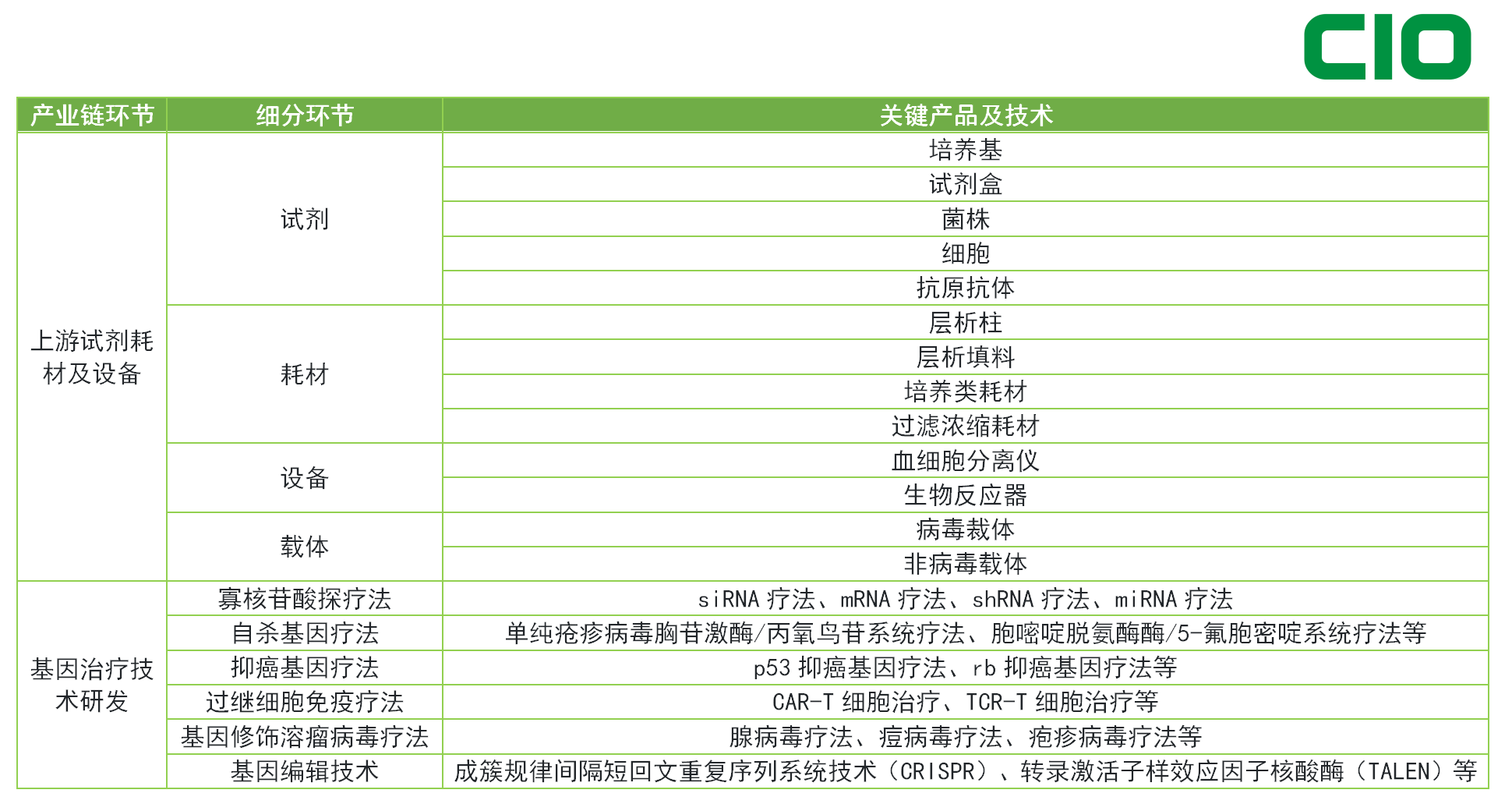
尽管基因治疗的类型多样,基因治疗产品的开发和生产始终以病毒载体技术为核心。他们通常都依赖于载体技术将遗传物质递送到细胞和生产病毒载体,作为生产过程中的一步或最终产品。
我们在CIO合规保证组织专家林宝琴的采访中了解到,AAV载体基因疗法为主流载体方式,占了79.7%。其他的还有腺病毒载体(8.9%),逆转录病毒载体(6.2%),慢病毒载体(3.7%),疱疹病毒载体(1.2%),其余载体占3.4%。
可以说,AAV基因治疗载能否大规模生产,是基因治疗领域突破的关键挑战。
二、全球基因治疗产品上市情况
随着基因治疗发展,基因治疗产品采用的载体安全性和有效性逐渐提升,全球已有20多个基因治疗产品上市(其中2个产品目前已撤市),产品类型涉及寡核苷酸类、溶瘤病毒、CAR-T疗法、干细胞疗法以及其他基于细胞的基因疗法。全球各地区获批情况如下图。
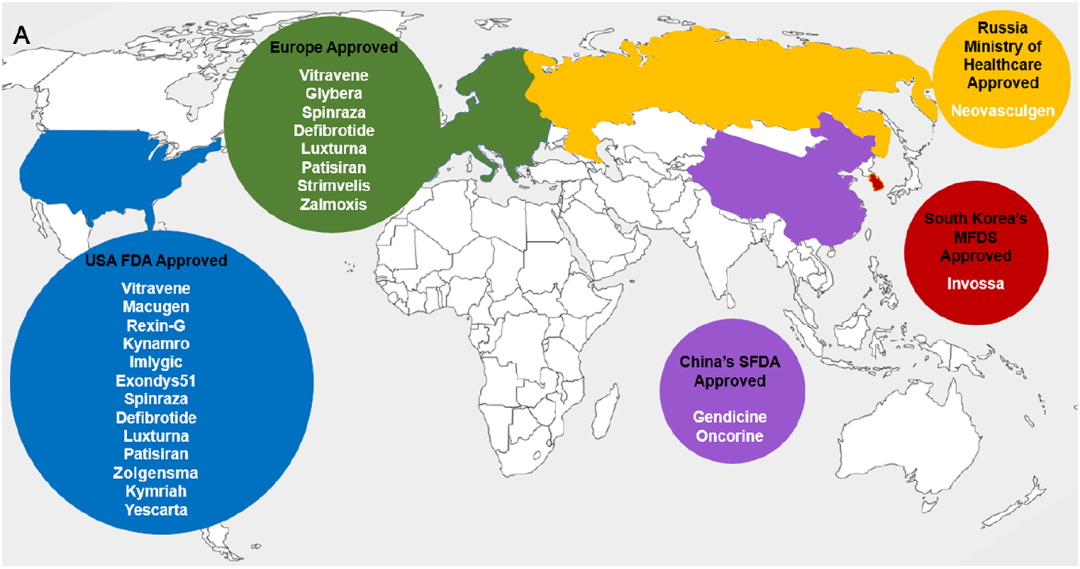
(来源:Shahryari A, etal. Front Genet. 2019)
Gendicine(今又生):于2003年在中国获批上市,由深圳市赛百诺公司研发,主要用于治疗头颈部鳞状细胞癌,是全球首个抗肿瘤基因治疗产品。通过携带有野生型p53基因的重组复制缺陷型人5型腺病毒,可通过表达抑癌基因p53,刺激机体产生特异性抗肿瘤免疫反应,上调多种抗癌基因和下调多种癌基因活性,从而增强抑癌作用,特异地引起肿瘤细胞程序性死亡,从而实现杀伤肿瘤的目的。
Oncorine(原H101)是一种重组人5型腺病毒,是中国食品药品监督管理局批准的首个用于癌症治疗的溶瘤病毒产品。其原理是利用工程病毒精准靶向肿瘤,同时病毒能在肿瘤细胞中自我繁殖,令其裂解,从而一举开创了人类利用病毒治疗肿瘤的先河。
三、国内基因治疗产品相关政策
CDE专家高建超认为,质量稳定、安全可控、疗效确切的细胞和基因治疗产品尚无法满足患者对新治疗手段的临床需求,是我国现阶段细胞和基因治疗产业发展的主要矛盾,主要表现在产业快速发展对监管体系的建设和完善提出更高要求,临床转化研究的规范性和科学性有待提高,上中下游的供应链发展不够成熟等方面。
2020年9月,CDE陆续开始发布关于基因治疗的指导原则,但截止至2021年12月依然没有一个转正。

四、从R&D到GMP的差距
已上市的基因疗法费用之所以如此高昂,是由于病毒载体工艺及大规模GMP生产的难度极高、工艺复杂、产能短缺和制备周期极长,未来十年内AAV工艺和大规模生产方面的挑战亟待突破。
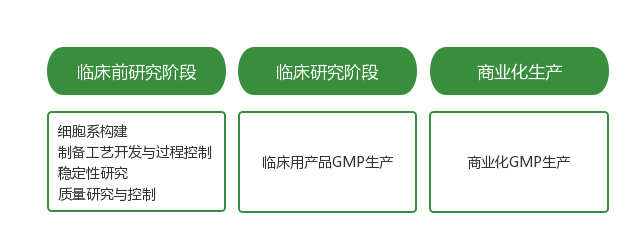
进行符合GMP标准的生产是基因治疗药物研发的关键步骤,且随着候选产品的研发与推进,申报IND、临床试验和商业化生产对于GMP产能的需求逐步提高。近年来,由于基因治疗新药研发投入的快速增加,全球范围内的病毒载体GMP产能接近瓶颈,具备大规模、高灵活性的GMP生产平台已成为基因治疗CDMO企业的重要竞争优势。高标准GMP生产平台的建成涉及定制化载体构建、先进生产工艺开发、基因药物质量管理体系搭建、供应链整合等多个领域,不仅需要大额资金投入,还要求基因治疗CDMO企业对于上下游生产工艺与质量控制、法规监管体系、GMP平台建设及验证具备深刻理解,强调企业的技术实力和项目执行经验。对于行业新进入者而言,由于缺乏综合积累,将面临较高的GMP体系壁垒。
如果您对生物药GMP有需求,点击下方联系我们
相关文件下载、服务及学习课程:
合规文库:药品生产质量管理规范-细胞治疗产品附录(征求意见稿)
合规培训:AAV基因治疗产品CMC开发的合规实践
联系专家,获取专家指导意见:e邀专家























