药械组合医疗器械注册指导原则来了,各地药械企业蓄势待发
CIO专家-元参
近日,总局医疗器械技术审评中心发布《药械组合医疗器械注册审查指导原则(征求意见稿)》,本指导原则主要对药械组合医疗器械中药物部分相关要求提供了指导,目的是更进一步指导申请人对药械组合医疗器械产品注册申报的准备,鼓励该类产品的创新发展。创新型组合产品市场持续升温,但还有这些问题需要关注!那么CIO合规保证组织小编带大家看看指导原则的重点在哪里。
一、药械组合医疗器械的定义
药械组合医疗器械是由药品与医疗器械共同组成,并作为单一实体生产的医疗产品,其中医疗器械作用为主的药械组合产品。注意:产品中所含药品可未单独获得上市许可。此类产品注册需要按照医疗器械申报。
二、注册申报和审查的基本要求
需按照《医疗器械注册申报资料要求及说明》准备相关注册申报资料,并在注册申请表中注明“药械组合产品”。其中安全性、有效性评估需要将产品作为整体进行评估。
三、注册申请时的特殊要求
CIO合规保证组织小编根据指导原则为大家整理了药械组合医疗器械注册申请时的特殊要求,见下图。

四、药械组合医疗器械的界定
CIO合规保证组织小编根据总局发布的“药械组合产品属性界定结果公告(181号)”为大家列举哪些产品属于这一类。
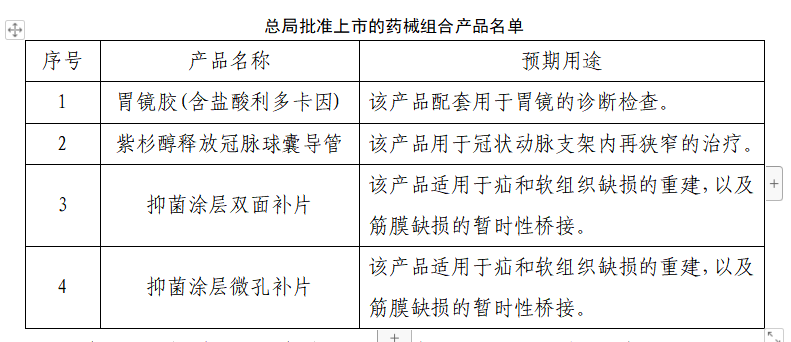
除了以上总局批准上市的药械组合,还有哪些产品已经被界定为药械组合医疗器械呢?敷料、疤痕贴、润滑胶、胶原海绵、生物蛋白海绵、髋关节组件、膝关节组件、海藻酸钠微球血管栓塞剂等都在今天讲的这个分类里。
当然,企业怎么知道自己的产品在这个分类里呢,在注册产品前需要进行产品界定,通过中国食品药品检定研究院网站进入办事大厅“医疗器械标准与分类管理”,点击进入“药械组合产品属性界定信息系统”填写《药械组合产品属性界定申请表》,并上传其他申请资料。
五、初次注册产品觉得有困难
药械组合医疗器械注册不同于普通的医疗器械备案,它对资料准备有很高的要求,根据总局发布的公告,很多企业在产品属性界定这一块就已经蒙头了,所以小编建议企业注册医疗器械可以寻找专业人士编写资料。
CIO合规保证组织成功帮多家企业进行药械组合产品申请,百余人专家团队,深入了解医疗器械全生命周期各个环节,帮助客户主动规避风险,缩短拿证周期。
相关文件下载、服务及学习课程:
合规文库:
《药械组合医疗器械注册审查指导原则(征求意见稿)》反馈意见表
合规服务:
远程服务:























