基本信息
1、办理部门:国家药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:北京市丰台区南四环西路188号12区29号楼
4、药监咨询:010-53815833 CIO咨询:400-003-0818
受理条件
申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。
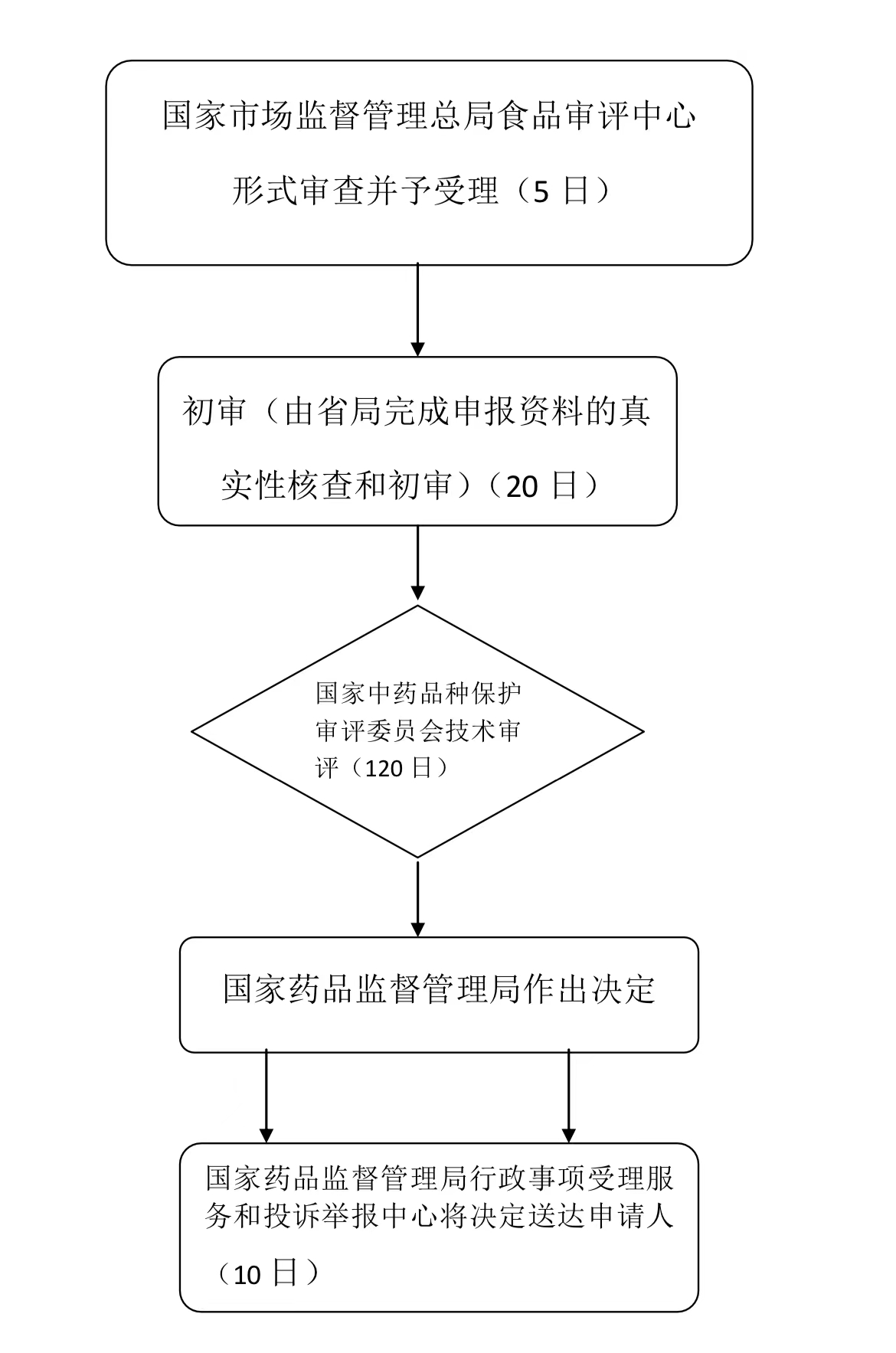
办理流程
流程文字说明
法定办结时限:20个工作日;承诺办结时限:5个工作日
1、受理;
2、初审(必要时组织现场检查);
3、技术评审(国家中药品种保护审评委员会组织专家评审);
4、行政许可决定;
5、送达。
申请材料
1、《中药保护品种补充申请表》。>>中药保护品种补充申请表
2、《国家中药保护品种审批件》(复印件)。
3、《中药保护品种证书》(复印件)。
4、药品监督管理部门核准变更有关事项的批复文件(复印件);批准事项为国家药品监督管理局备案的补充申请(如变更药品生产企业名称等),应提供省级药品监督管理局的批复文件及以新企业名称重新注册该品种的批复文件(复印件)。
结果样本


常见问题
问题1:办理补充批件需提供哪些资料?
答:应按照原国家食品药品监督管理局《关于印发中药品种保护指导原则的通知》(国食药监注〔2009〕57号)要求,提供以下资料:①《中药保护品种补充申请表》;②《国家中药保护品种审批件》(复印件);③《中药保护品种证书》(复印件);④药品监督管理部门核准变更有关事项的批复文件(复印件);批准事项为国家药品监督管理局备案的补充申请(如变更药品生产企业名称等),应提供省级药品监督管理部门的批复文件及以新企业名称重新注册该品种的批复文件(复印件);⑤《药品生产许可证》、《药品GMP证书》(复印件);⑥省级药品监督管理部门审核意见表;⑦其它需要提交的资料。
问题2:何时应提出中药保护品种补充申请?
答:中药保护品种审批件及证书中有关事项发生变更时,该保护品种生产企业应提出补充申请。
问题3:补充申请的受理程序
答:根据原国家食品药品监督管理局《关于印发中药品种保护指导原则的通知》(国食药监注〔2009〕57号)要求,补充申请资料应经省级药品监督管理部门审核后提交至国家市场监督管理总局食品审评中心受理大厅,国家市场监督管理总局食品审评中心受理大厅对符合有关规定的申请予以受理。
本办事指南摘自药监局官网,如有变动,以官方发布为准。