基本信息
1、办理部门:湖南省药品监督管理局
2、办理方式:网上办理
3、办理地点:长沙市天心区银杏路6号政务服务大厅一楼B19-B26窗口
4、咨询电话:0731-82213690 CIO咨询:400-003-0818
受理条件
一、申请人为具有独立民事责任能力的公民、法人或组织。
二、申请人无违反《中华人民共和国药品管理法》第116条、第118条、第122条、第123条、第124条、第125条、第126条、第141条、第142条等禁止从事药品生产经营活动规定的情形 。
三、具备《中华人民共和国药品管理法》第41条、第42条,《药品生产监督管理办法》第6条、第7条规定的条件。
四、符合《药品生产监督管理办法》 ( 国家市场监督管理总局令第28号 ) 第2章的规定。
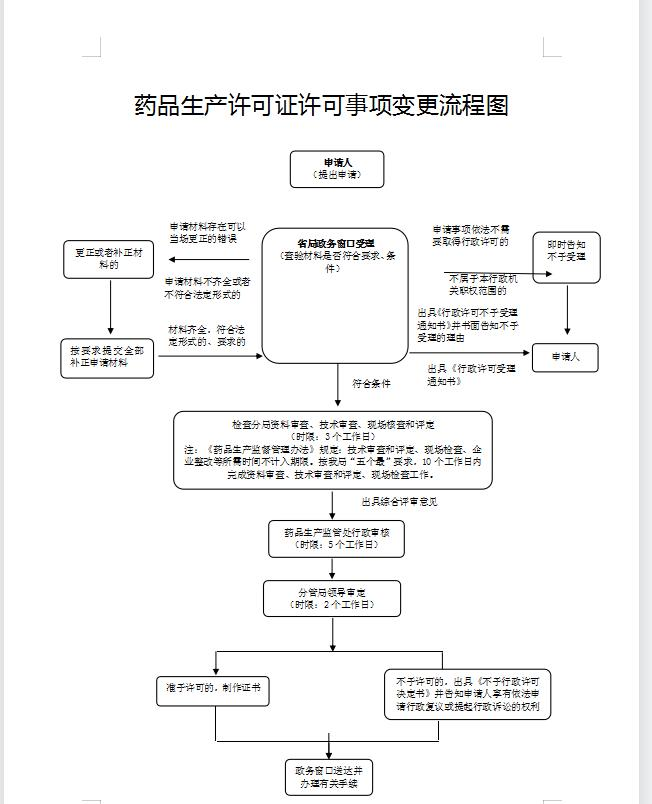
办理流程
流程文字说明
法定办结时限:15个工作日;承诺办结时限:10个工作日。
1、受理:0个工作日
办理结果:按照法定要求对申请材料进行形式审查,并根据下列情况分别作出处理:
(1)申请事项依法不需要取得行政许可的,应当即时告知申请人不受理;
(2)申请事项依法不属于本部门职权范围的,应当即时作出不予受理的决定,并告知申请人向有关行政机关申请;
(3)申请材料存在可以当场更正的错误的,应当允许申请人当场更正;
(4)申请材料不齐全或者不符合形式审查要求的,应当当场或者在五日内发给申请人补正材料通知书,一次性告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理;
(5)申请材料齐全、符合形式审查要求,或者申请人按照要求提交全部补正材料的,予以受理;
(6)受理或者不予受理行政许可申请,应当出具加盖本部门专用印章和注明日期的《受理通知书》或者《不予受理通知书》。
2、资料审查、技术审查、现场核查和评定:3个工作日
办理结果:(1)资料审查:按照许可条件及申报材料要求对申请资料进行审查。
(2)技术审查:对申请人提交的申请材料进行完整性、合法性审查。不符合要求的,书面说明理由直接交政务窗口退审;经审查需要企业补充材料的,制作《补充材料通知书》,在现场检查时一并补充完善。
(3)现场检查:对企业发出现场检查通知,组织检查员按照《药品生产监督管理办法》《药品生产质量管理规范》等有关规定进行现场检查。申请人完成整改并提交整改报告,对整改情况进行审查或复查。
(4)综合评定:根据技术审查、现场检查和企业整改情况,对企业进行综合评价,出具综合评定意见。
3、行政审核:5个工作日
办理结果:经办人对申报资料和检查分局技术审查、现场核查及综合评定情况进行综合审查,提出并在审批表上签署初审意见;处室负责人根据初审情况和意见在审批表上签署审核意见;报分管局领导审定。
4、审批:2个工作日
办理结果:(1)对审核意见进行审定,符合法定条件的,作出行政许可决定,在审批表上签署同意的意见;(2)不符合法定条件的,不予许可,在审批表上签署不同意的意见,并说明理由。
5、制证与送达:0个工作日
办理结果:(1)对同意发《药品生产许可证》的,药品生产监管处工作人员在审批系统中填写并核对许可信息,由省局政务窗口制作《药品生产许可证》并送达申请人;
(2)对不同意核发《药品生产许可证》的,由药品生产监管处工作人员制作《不予行政许可决定书》,交省局政务窗口送达申请人;《不予行政许可决定书》中应书面说明不予许可理由,并告知申请人享有依法申请行政复议或提起行政诉讼的权利。
申请材料
1、证明文件;
2、组织机构图;
3、验证、校验情况;
4、布置图;
5、平面图;
6、文件目录;
7、申请材料封面和目录;
8、申请报告;
9、授权委托书;
10、工艺流程图;
11、材料真实性声明;
12、基本情况;
13、人员资质材料;
14、设备及仪器目录;
15、质量标准。
结果样本

常见问题
问题1:申请《药品生产许可证》需要符合什么条件?
答:根据2019年8月26日已修订《中华人民共和国药品管理法》(中华人民共和国主席令第31号) 第四十一条 从事药品生产活动,应当经所在地省、自治区、直辖市人民政府药品监督管理部门批准,取得药品生产许可证。无药品生产许可证的,不得生产药品。 药品生产许可证应当标明有效期和生产范围,到期重新审查发证。
第四十二条 从事药品生产活动,应当具备以下条件:
(一)有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人;
(二)有与药品生产相适应的厂房、设施和卫生环境;
(三)有能对所生产药品进行质量管理和质量检验的机构、人员及必要的仪器设备;
(四)有保证药品质量的规章制度,并符合国务院药品监督管理部门依据本法制定的药品生产质量管理规范要求。
本办事指南摘自药监局官网,如有变动,以官方发布为准。