基本信息
1. 办理部门:广东省药品监督管理局
2. 办理方式:网上办理、现场办理
3. 办理地点:广州市东风东路753号之二1楼业务受理大厅
4. 药监咨询:020-37886014 CIO咨询:400-003-0818
受理条件
申请人必须符合以下所有要求:
1、具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人,应满足《药品生产质量管理规范》第三章的要求;
2、具有与其药品生产相适应的厂房、设施和卫生环境;
3、具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备;
4、具有保证药品质量的规章制度;
5、新增生产范围应符合国家制定的药品行业发展规划和产业政策;
6、药品生产企业新建、改建、扩建生产车间的必须验收合格;
7、企业名称、法定代表人、注册地址、社会信用代码等项目应当与工商行政管理部门核发的营业执照中载明的相关内容一致。
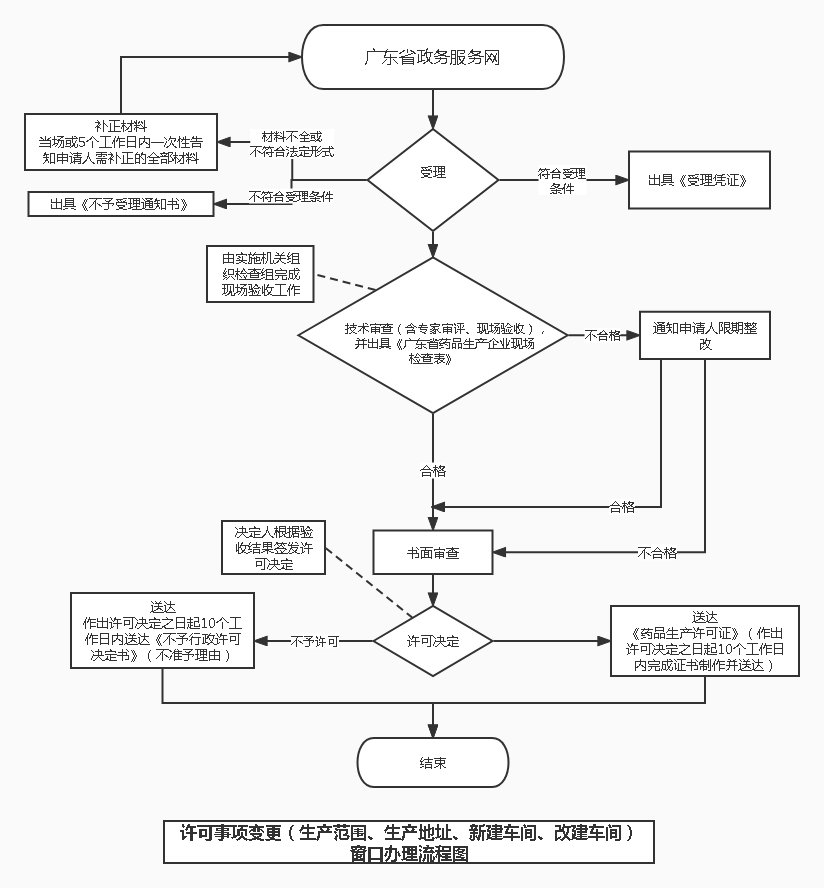
办理流程
流程文字说明
法定办结时限:15个工作日;承诺办结时限:10个工作日
1.收件(时限:5个工作日)
办理结果:向申请人出具收件凭证(含申请编号)。
2.受理(时限:0个工作日)
办理结果:1.能当场受理或通过当场补正达到受理条件的,直接进入受理步骤,当场出具受理通知书;2.根据一次性告知通知书内容进行补正后达到受理条件的,出具决定受理通知书;3.收件之日起5个工作日内未收到一次性告知通知书的,从收件之日起即为受理。
3.审查(时限:5个工作日)
办理结果:符合审查要求,转处领导审批。
4.决定(时限:5个工作日)
办理结果:符合要求,予以发证。
5.制证(时限:10个工作日)
办理结果:批准证书或准予许可决定书或不予行政许可决定书。
申请材料
1. 《药品生产许可证变更申请表》与申请报告。>>药品生产许可证变更申请书
2. 《药品生产许可证》正、副本原件。
3. 企业的总平面布置图。
4. 发生变更的车间生产工艺布局平面图。
5. 本次变更涉及到的生产范围、剂型、品种、质量标准及依据。
6. 本次变更涉及到的生产剂型或品种的工艺流程图,并注明主要质量控制点与项目需要同时申请的登记事项变更情况及相关资料。
7. GMP符合性检查申请材料(根据国家药监局关于实施新修订《药品生产监督管理办法》有关事项的公告(2020年第47号)附件2进行提供,如不需要进行GMP符合性检可不提供)。
结果样本

常见问题
问题1:厂房设施需制订哪些可参考的管理类SOP?
答:《厂方设计管理程序》、《厂房施工管理程序》、《厂房验收管理程序》、《厂房保养、维修程序》、《图纸管理程序》。
本办事指南摘自药监局官网,如有变动,以官方发布为准。