基本信息
1、办理部门:江苏省药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:南京市建邺区汉中门大街145号江苏省政务服务中心省药监局窗口
4、咨询电话: 12315 CIO咨询:400-003-0818
受理条件
材料齐全,符合法定形式。
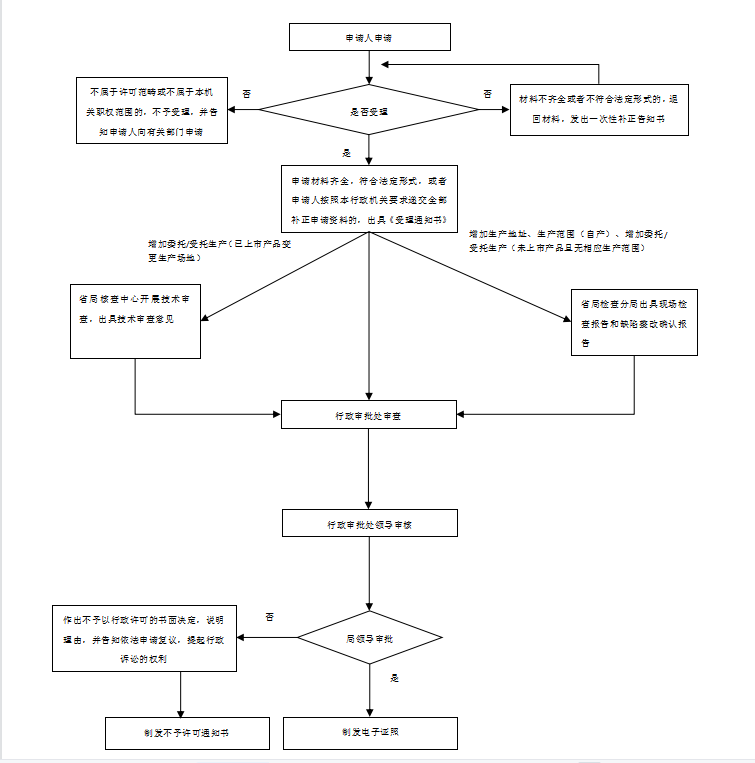
办理流程
流程文字说明
1、受理(时限:5个工作日)
办理结果:在5个工作日内,对不属于许可范畴或不属于本机关职权范围的,不予受理,并出具《不予受理通知书》;对申请资料不齐全或不符合法定形式的,出具《补正通知书》,一次性告知申请人需要补正的全部内容;对申报资料齐全或已经按照要求提交全部补正申请资料的申请作出受理决定,出具《受理通知书》。
2、审查(时限:10个工作日)
办理结果:符合许可要求的,制作《药品生产许可证》正副本。不符合许可要求的,出具《不予许可通知书》。
3、送达(时限:0个工作日)
办理结果:药品生产行政审批系统对接省局智慧政务服务平台(供企业查看、下载、打印)。
申请材料
1、委托方企业申请报告(说明此次变更的背景、原因);
2、委托方《药品生产许可证变更申请表》;>>《药品生产许可证》变更申请表
3、委托方药品批准证明文件(未上市产品免于提供);
4、委托方和受托方原《药品生产许可证》正副本(本省企业系统自动获取、外省企业需上传复印件);
5、委托方拟委托生产的范围、剂型、品种、质量标准及依据;
6、委托方拟委托生产剂型及品种的工艺流程图,并注明主要质量控制点与项目、受托方共线生产情况;
7、委托方拟委托生产产品所在生产车间生产工艺布局平面图、工艺设备平面布置图;
8、委托方委托协议和质量协议;
9、持有人确认受托方具有受托生产条件、技术水平和质量管理能力的评估报告;
10、委托方药品上市放行规程;
11、受托方药品出厂放行规程;
12、受托方所在地省级药品监管部门出具的通过药品GMP符合性检查告知书以及同意受托生产的意见(委托产品为未上市品种,且受托生产所在生产线尚未通过GMP符合性检查的,可免于提供GMP符合性检查告知书,提供具备相应生产地址和生产范围的受托方《药品生产许可证》或符合《药品生产监督管理办法》第六条相 关要求的许可检查报告);
13、委托方经办人不是法定代表人本人,企业应当提交《法定代表人授权委托书》及被委托人身份证复印件;
14、委托方申报单位对申报资料的真实性作的保证声明;>>承诺书
15、受托方企业申请报告(说明此次变更的背景、原因);
16、受托方《药品生产许可证变更申请表》;>>《药品生产许可证》变更申请表
17、委托方和受托方原《药品生产许可证》正副本(本省企业系统自动获取、外省企业需上传复印件;委托方尚未取得《药品生产许可证》的应提交营业执照复印件);
18、药品批准证明文件(未上市产品免于提供);
19、受托方拟接受委托生产的范围、剂型、品种、质量标准及依据;
20、受托方拟接受委托生产剂型及品种的工艺流程图,并注明主要质量控制点与项目、共线生产情况;
21、受托方拟接受委托生产产品所在生产车间生产工艺布局平面图、工艺设备平面布置图;
22、受托方 药品出厂放行规程;
23、受托方委托协议和质量协议;>>协议模板
24、受托方经办人不是法定代表人本人,企业应当提交《法定代表人授权委托书》及被委托人身份证复印件;
25、受托方申报单位对申报资料的真实性作的保证声明。>>承诺书
结果样本

常见问题
问题1:GMP认证取消后,在什么情况下需要申请GMP符合性检查?
答:根据《药品生产监督管理办法》,需要进行GMP符合性检查的情况主要有:
1.原址或者异地新建、改建、扩建车间或者生产线的;
2.未通过与生产该药品的生产条件相适应的药品生产质量管理规范符合性检查的品种;
3.已通过与生产该药品的生产条件相适应的药品生产质量管理规范符合性检查的品种,相关省、自治区、直辖市药品监督管理部门根据风险管理原则决定是否开展上市前的药品生产质量管理规范符合性检查。
本办事指南摘自药监局官网,如有变动,以官方发布为准。