基本信息
1、办理部门:上海市药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:上海市徐汇区虹梅路街道宜山路728号3号楼底楼大厅上海市药品监督管理局行政服务中心1-5号窗口。
4、咨询电话: 021-63269368 CIO咨询:400-003-0818
受理条件
申请材料齐全,符合法定形式,具体见申请材料目录。
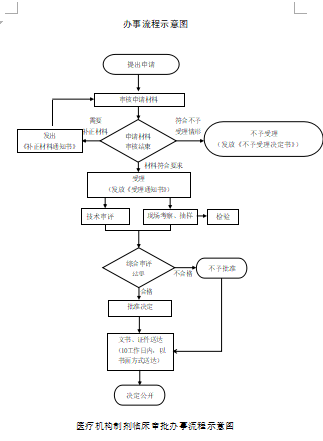
办理流程
流程文字说明
1、申请:申请人通过省政务服务网网上申报,并提交相关电子申请材料。申请人按照申报资料要求,提供一套纸质材料,通过邮寄或直接递交,或者委托相关人员递交省药品监督管理局受理大厅。
2、受理:5个工作日 。
申请材料齐全,符合法定形式,具体见申请材料目录。
3、审查与决定:10个工作日。
办理结果:
(一)准予批准的条件: 医疗机构所申报的品种材料符合《医疗机构制剂注册管理办法(试行)》相关规定和要求(详见《医疗机构制剂注册管理办法(试行)》第二章及附录)。
(二)不予批准的情形:有下列情形之一的,不得作为医疗机构制剂申报:(1)市场上已有供应的品种;(2)含有未经国家食品药品监督管理局批准的活性成份的品种;(3)除变态反应原外的生物制品;(4)中药注射剂;(5)中药、化学药组成的复方制剂;(6)麻醉药品、精神药品、医疗用毒性药品、放射性药品;(7)其他不符合国家有关规定的制剂。
4、颁证与送达:10个工作日。
直接送达(电子证件推送)。
申请材料
1、医疗机构制剂注册申请表;>>医疗机构制剂注册申请表
2、制剂名称及命名依据;
3、立题目的以及该品种的市场供应情况;
4、证明性文件;
5、标签及说明书设计样稿;
6、处方组成、来源、理论依据以及使用背景情况;
7、配制工艺的研究资料及文献资料;
8、质量研究的试验资料及文献资料;
9、制剂的质量标准草案及起草说明;
10、制剂的稳定性试验资料;
11、样品的自检报告书
12、辅料的来源及质量标准;
13、直接接触制剂的包装材料和容器的选择依据及质量标准;
14、主要药效学试验资料及文献资料;
15、急性毒性试验资料及文献资料;
16、长期毒性试验资料及文献资料;
17、临床研究方案。
结果样本

常见问题
问题1:哪些情形可以免于临床研究?
答:1.申请配制的化学制剂属已有同品种获得制剂批准文号的;2.根据中医药理论组方,利用传统工艺配制(即制剂配制过程没有使原组方中治疗疾病的物质基础发生变化的),且该处方在本医疗机构具有5年以上(含5年)使用历史的中药制剂。(*仅应用传统工艺配制的中药制剂品种,向医疗机构所在地省、自治区、直辖市人民政府药品监督管理部门备案后即可配制。)
本办事指南摘自药监局官网,如有变动,以官方发布为准。