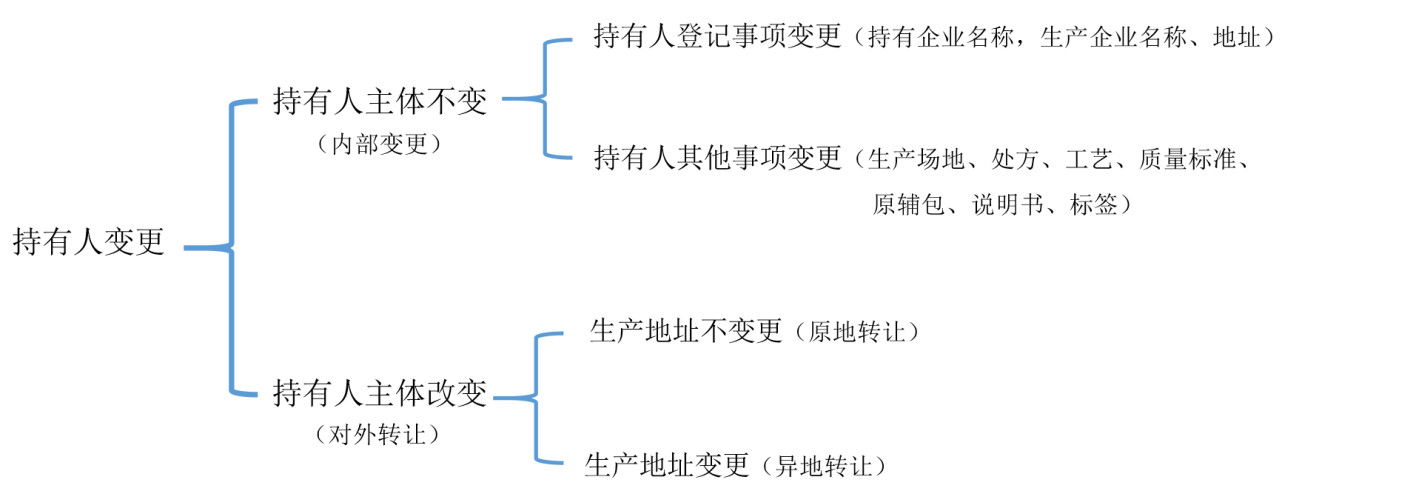
药品上市后变更分类及持有人变更流程
CIO专家-丹参
药品上市后变更分类及持有人变更流程
2021年1月13日,国家药监局发布了《药品上市后变更管理办法(试行)》,《办法》落实了《药品管理法》对药品生产过程中的变更按照风险及影响程度实行分类管理的要求,明确了持有人是药品上市后变更的责任主体,规定了药品上市后变更的分类原则和常见情形,为药品上市后的变更管理提供了充足依据。
本文将对药品上市后变更事项进行梳理和总结,旨在为药品注册申报人员提供参考。
一、药品上市后变更事项的分类
药品上市后的变更分为生产监管事项变更和注册管理事项变更。
根据《药品生产监督管理办法》,生产监管事项变更分为许可事项变更和登记事项变更。药品生产许可事项变更是指生产地址变更和生产范围变更,需要进行技术审查及现场检查。药品生产登记事项变更是指企业名称、住所(经营场所)、法定代表人、企业负责人、生产负责人、质量负责人、质量受权人等变更,仅需审核资料即可完成变更。
根据《药品注册管理办法》,药品注册管理事项变更分为审批类变更、备案类变更和报告类变更(注册管理办法第78,79,80条规定)。药品注册管理事项的变更是指药品注册批准证明文件及其附件载明的技术内容和相应管理信息的变更,其中药品注册证书载明内容包括药品批准文号、持有人、生产企业等信息,其附件包括经核准的药品生产工艺、质量标准、说明书和标签以及上市后研究要求等。
二、持有人变更流程
根据《药品上市后变更管理办法》,持有人变更按区域进行划分有以下三类:(1)境内生产药品持有人的变更;(2)境外持有人之间变更;(3)在境内上市的境外生产药品转移至境内生产。
如果按照持有人主体是否变更进行划分,则分为持有人主体改变和持有人主体不变两类,具体如下:
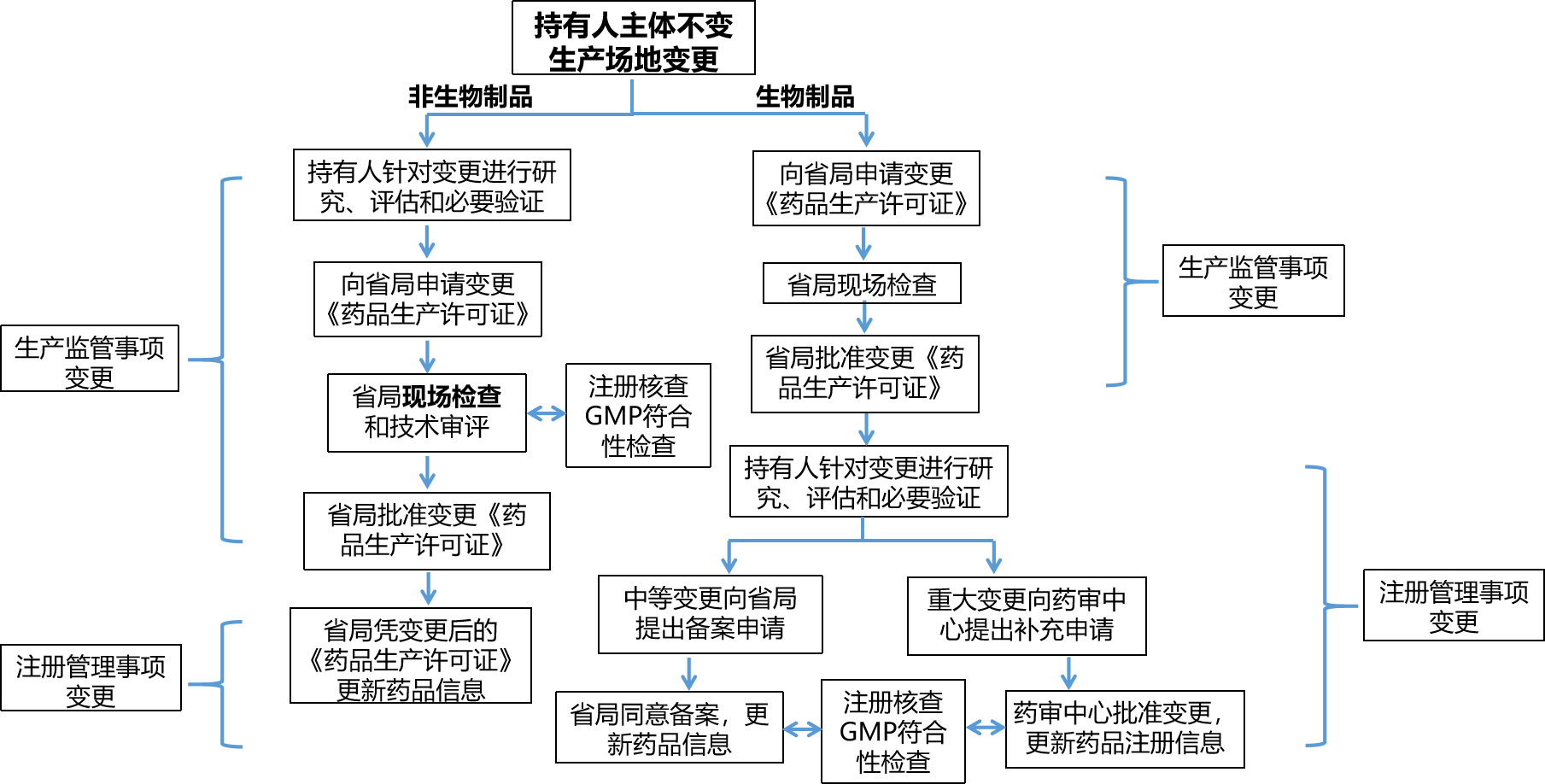
1、持有人主体不变更申报流程
持有人主体不变更,生产场地、处方、工艺、质量标准、原辅包、说明书和标签有变更,其变更申报流程如下(以生产场地变更为例):
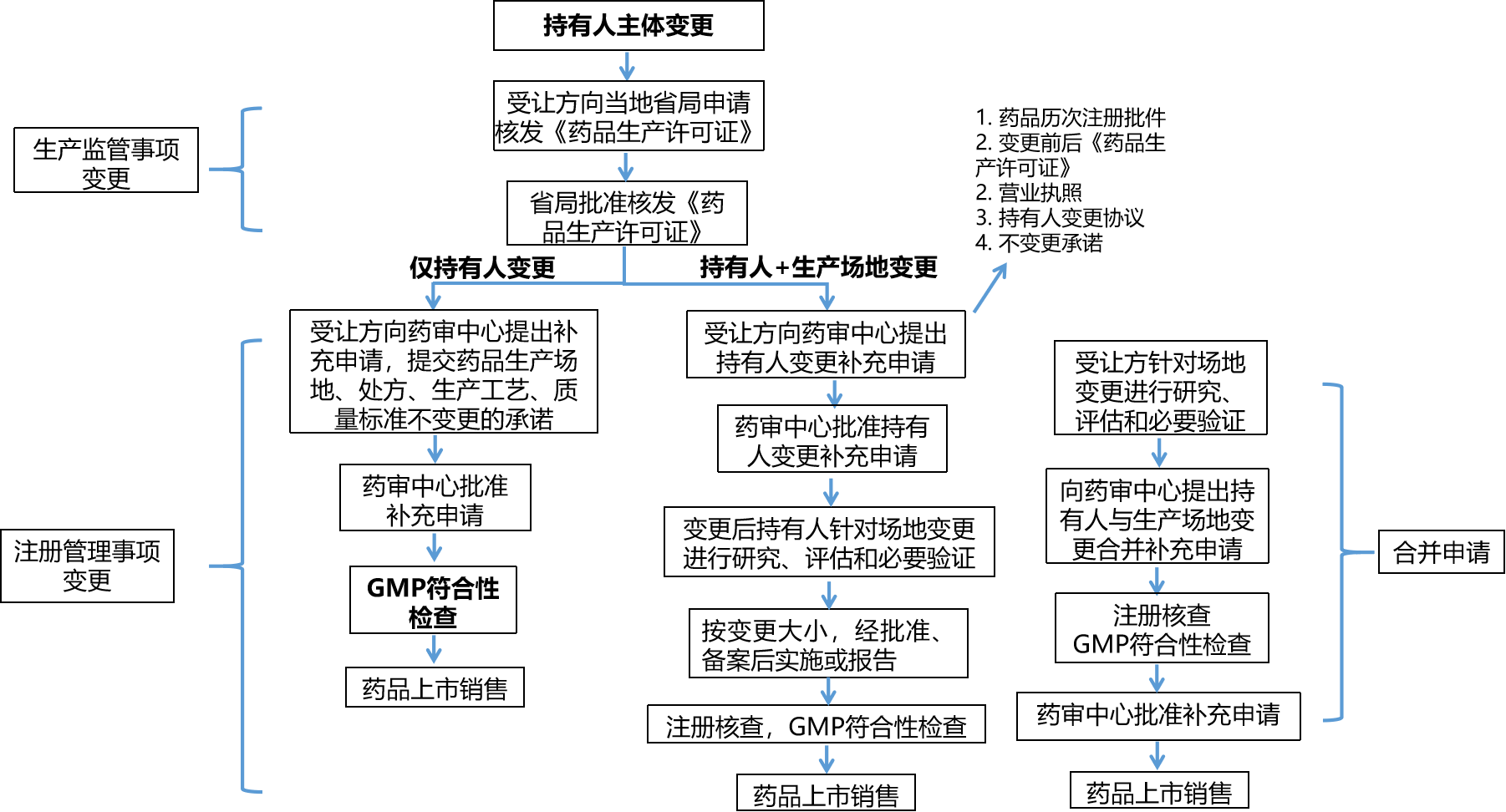
2、持有人主体变更申报流程图
持有人主体变更,生产场地、处方、工艺、质量标准、原辅包、说明书和标签有变更,其变更申报流程如下(以持有人变更+生产场地是否变更为例):
三、变更审批及实施时间
药品上市后变更申请时间根据变更类别(审批类变更、备案类变更,报告类变更)及是否需要技术审评,申请时间有一定的区别。
1、审批类变更申请时间:不需技术审评最长3个月,需技术审评最长6个月,若发补,最长需11个月。
(1)受理所需时间(35日):5日内形式审查并通知补正,申请人在30日内补正资料;
(2)审评时限:单项申请60日,合并申请80日,延长时间不超过1/3。
(3)技术资料补充时限:80日(不计入审评时限)。
(4)行政审批决定:20日
(5)制证,送达:10日
2、备案类变更申请时间:最长3个月
(1)受理所需时间(35日):5日内形式审查并通知补正,申请人在30日内补正法定资料;
(2)资料审查:30日内完成资料审查。
3、报告类变更:年度报告。
4、变更实施时间:最长不得超过变更批准后6个月。
《药品上市后变更管理办法》是《药品管理法》、《药品注册管理办法》的细化,与《药品生产监督管理办法》相互辉映、相互配合。它强化了药品上市许可持有人的药品上市后变更管理责任,对行业内关注的药品持有人转让、生产场地变更等焦点问题做出了明确的规定,它为药品研发注册管理人员指明了工作方向,具有重要意义。






















