从广东113个医疗器械产品通过试点审批,谈医疗器械注册人制度
CIO专家-元参
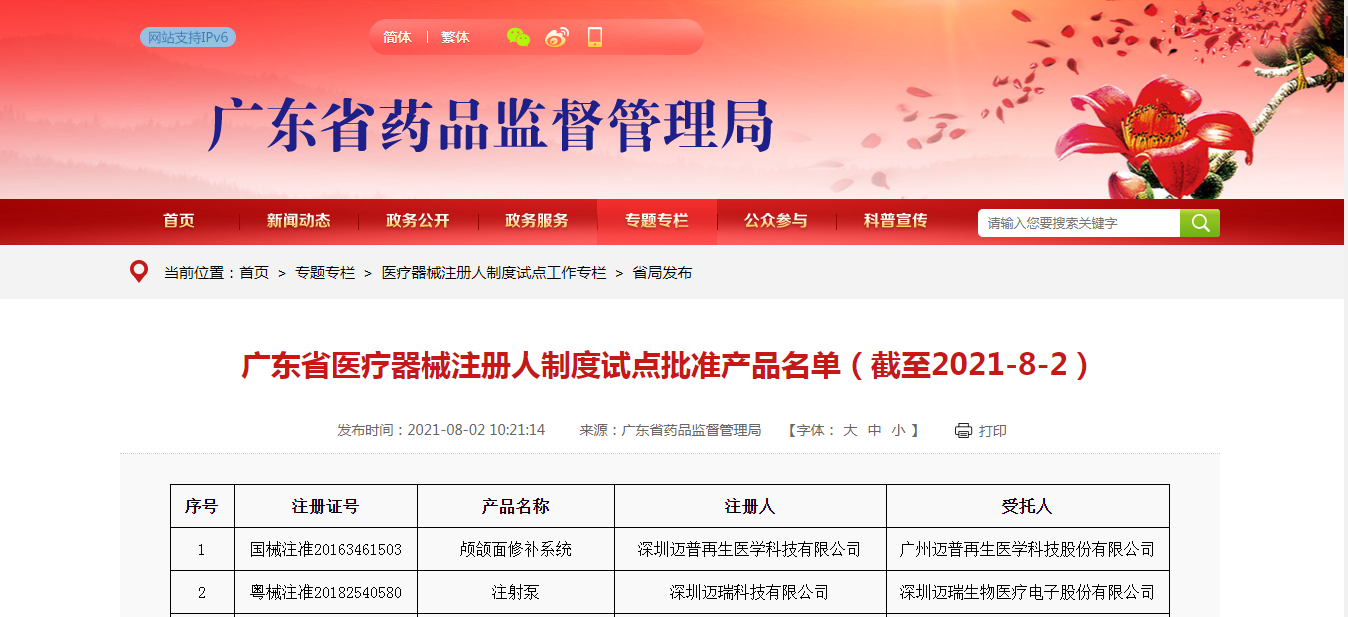
8月初,广东省药监局发布《广东省医疗器械注册人制度试点批准产品名单》,截止2021年8月2日,共有40家医疗器械企业的113个医疗器械产品通过注册人制度试点审批。接下来CIO合规保证组织小编结合医疗器械注册人制度,谈谈各企业在申请医疗器械注册时应该注意什么?
一、医疗器械注册人制度是什么?
新修订的《医疗器械监督管理条例》总结了这几年试点的经验,进一步明确了医疗器械注册人制度的核心内容。国家药监局副局长徐景和介绍到,该制度的核心要义是医疗器械注册人是医疗器械产品的“出品人”,对研制、生产、经营、使用全过程的医疗器械安全性、有效性依法承担责任。
二、围绕医疗器械注册人制度的几个问题?
2018年开始,国家药监局启动了医疗器械注册人制度试点工作,试点范围达到了22个省、自治区、直辖市。试点工作主要围绕以下几个方面展开:
1、科研机构是否可以成为医疗器械注册人?
答:可以。此次广东发布的名单中包括科研机构和医疗器械经营企业。
2、注册人委托生产时,与受托人之间的权利、义务如何划分?
根据《广东省医疗器械注册人委托生产质量管理体系实施指南》,注册人负责医疗器械全链条和全生命周期管理,对医疗器械设计开发、临床评价、生产制造、销售配送、售后服务、产品召回、不良事件报告等承担全部法律责任,确保提交的研究资料和临床数据真实、完整、可追溯,确保对上市医疗器械进行持续研究,及时报告不良事件及其风险评估情况,提出并落实处置措施。

3、异地委托生产时,监管部门的权力和责任如何配置?
根据《医疗器械生产监督管理办法》,委托生产第二类、第三类医疗器械的,委托方应当向所在地省、自治区、直辖市药品监督管理部门办理委托生产备案;委托生产第一类医疗器械的,委托方应当向所在地设区的市级药品监督管理部门办理委托生产备案。符合规定条件的,药品监督管理部门应当发给医疗器械委托生产备案凭证。
4、注册人全生命周期的责任如何有效落实?
一是在生产环节。新《条例》第三章专门对医疗器械生产予以法规规范,规定了医疗器械注册人从事医疗器械生产活动,应当具备相应的生产设施设备和专业技术人员、检验机构和检验设备、保证产品质量的管理制度和售后服务能力,以及质量管理体系的相关要求,并经监管部门审核许可后方可生产。
二是在经营使用环节。新《条例》第四章对医疗器械经营与使用进行规范,规定了从事医疗器械经营活动,应当有相应的经营场所和贮存条件,以及质量管理制度和质量管理机构,并经监管部门许可或者办理备案后方可经营。同时,还明确医疗器械注册人、备案人在其住所或者生产地址销售自己注册、备案的医疗器械,无需办理医疗器械经营许可或者备案,但应当符合规定的经营条件。
三是在不良事件监测和再评价方面。新《条例》第五章对医疗器械不良事件的处理提出了明确要求,规定了医疗器械注册人、备案人应当建立医疗器械不良事件监测体系,对其上市产品主动开展不良事件监测,及时采取调查、分析、评价、产品风险控制等措施,并按照有关管理规定,通过不良事件监测网络信息系统报送监测机构。
三、医疗器械企业在注册的时候会碰到的困窘
1、注册人如何建立质量管理体系?
2、如何编写委托协议、委托合同和质量协议?
3、在哪里找有资质的第三方对受托方开展质量审核?
4、产品上市放行方式如何确定?
5、如何建立售后服务相关制度?
6、委托生产变更应该走哪些程序?
7、委托医疗器械销售时应该注意什么?
8、如何保证受托方和委托方在设计开发等技术文件上的一致性?
以上都是CIO合规保证组织来自全国各地器械企业共同面临的问题,CIO合规保证组织聚集十多位医疗器械领域专家,拥有丰富的医疗器械注册经验,持续为企业提供医疗器械注册、委托协议编写、第三方评估等合规服务,解决企业在医疗器械注册和委托生产中碰到的法规问题,为注册人全程保驾护航。

CIO合规保证组织,专注于研究医药监管科学,在药品、医疗器械、化妆品、保健食品等领域,构建了产品研发、临床研究、注册、生产、流通、使用、不良反应、药物警戒等全生命周期中所有核心环节的服务体系,用审计、顾问、培训、认证等服务方式,为各地药监部门、企业、投资者、从业者等提供优质的服务。
相关文件下载、培训及服务:
合规文库:
广东省食品药品监督管理局关于印发《广东省医疗器械注册人制度试点工作实施方案》的通知
合规培训:
合规服务:
远程服务:























