 查看详情
查看详情主动召回,保障人民群众用械安全,促进产业高质量发展
大家好!3月6日,广东省药监局官网发布了一则医疗器械企业主动召回公告。信息显示,广东某医疗器械生产企业在产品抽检中发现不合格批次后,立即启动主动召回程序,召回级别定为三级。通过对问题产品的及时回收处理,可有效减少因使用缺陷产品引发不良事件的可能性,切实保障医疗器械的安全性与有效性...
 查看详情
查看详情【药企多】目前药品批文转让有哪些新的政策制约和动向
目前药品批文转让有哪些新的政策制约和动向大家好,这里是CIO在线 -药企多医药产业投资与转让平台。今天我们来分享下目前批文转让在政策层面面临多方面的制约和动向,目前批文转让在政策层面面临的主要制约包括:批文变更时间延长;跨省转让受限;新批文审批期间和上市三年内的转让限制;时间和上...
 查看详情
查看详情
 查看详情
查看详情门槛和研发效能都大大提高!国家局发布医疗器械临床试验项目检查要点及判定...
3月12日,国家药监局官网公示医疗器械临床试验项目核查重点及评估准则,明确该标准将于5月1日正式生效。根据公告要求,新提交的注册申请项目将依据本准则开展临床核查,正在审评阶段的注册申请项目也需同步参照执行。核查内容涵盖七个维度,共15项重点
 查看详情
查看详情为深圳罗伯医疗科技点赞,首个消化内镜整合型机器人上市
2025年3月12日,国家药监局官网发布通告,我国首款消化道内窥镜手术器械一体化机器人系统——由深圳市罗伯医疗科技有限公司研发的创新型设备,已经获得国家药监局的批准上市。
 查看详情
查看详情医疗器械临床试验审计,现场检查新规发布,72项检查要点!
昨日,国家药监局发布了新版《医疗器械临床试验项目检查要点及判定原则》的公告,自2025年5月1日施行,旧版文件同时废止。根据公告,医疗器械临床试验项目的检查将聚焦于临床试验条件与合规性、受试者权益保障、临床试验方案、临床试验实施过程、临床试验数据记录溯源与报告、试验医疗器械管理六...
 查看详情
查看详情医疗器械分类界定工作流程大揭秘!1个网站搞定所有
想申报器械注册但分不清管理类别的都看过来了!首先是提交申请:打开网站“中国食品药品检定研究院”,从“办事大厅”的“医疗器械标准与分类管理”中进到“医疗器械分类界定信息系统”页面,按要求登录并在线提交申请资料即可。
 查看详情
查看详情“经导管三尖瓣环成形系统”获批| 我国过去十年医疗器械审评审批制度改革...
2025年3月11日,国家药监局官网发布公告,上海汇禾医疗科技股份有限公司研发的经导管三尖瓣环成形系统的创新产品注册申请获得批准上市。(以下简称K-Clip)当前,全球经导管三尖瓣介入治疗领域呈现爆发式增长。2021年至2030年,全球相关手术量预计从340例攀升至45万例,市场...
 查看详情
查看详情GMP认证取消了是不是就不用做GMP检查了?
GMP认证取消了怎么还要做GMP符合性检查?不少来咨询的朋友都发出过类似的疑问,觉得GMP认证取消了就没必要做GMP检查了,费时费力费成本。但实际上,CIO一直强调的是,GMP认证取消,更改为GMP符合性检查后,对于企业来说,其实是更为严格的。根据《药品生产监督管理办法》第五十五...
 查看详情
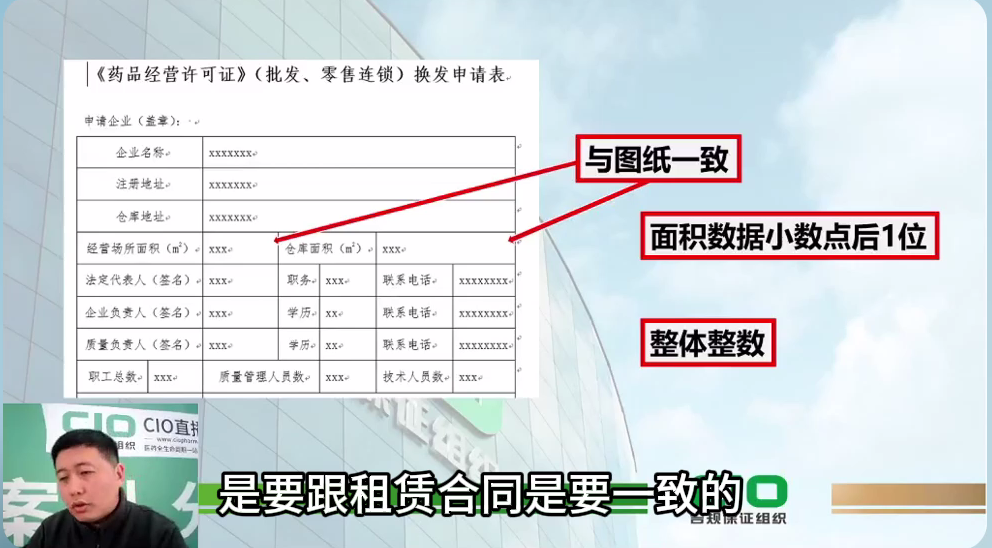
查看详情【课程】药品经营企业到期换证,申报资料注意事项
课程| 药品经营企业到期换证,申报资料注意事项一、申报表。可以去省局的办事指南大厅下载专门的模板,进行手工填写时候要注意:1)企业的申请,申请企业(盖章)位置,要求写上企业的全名,要盖章,名字是打印的,打印出来后在盖章,好多企业以为只是盖个章就可以,不是写公司名称这种情况。2)企...





