基本信息
1、办理部门:北京市药品监督管理局
2、办理方式:窗口办理,网上办理,快递申请
3、办理地点:
北京市政务服务中心——北京市丰台区西三环南路1号(六里桥西南角)(1-3层综合窗口)
北京城市副中心政务服务中心——北京市通州区新华东街48号二区(东南角)(综合窗口)
4、咨询电话: (010)89150290 CIO咨询:400-003-0818
受理条件
1、申请材料应完整、清晰,需将复印件逐页加盖单位公章,要求签字的须签字,扫描为PDF文件后上传。2、进口药品合法身份证明性文件原件真实,原件与复印件内容一致且在有效期内; 3、报验单位合法资质证明性文件齐全、有效。
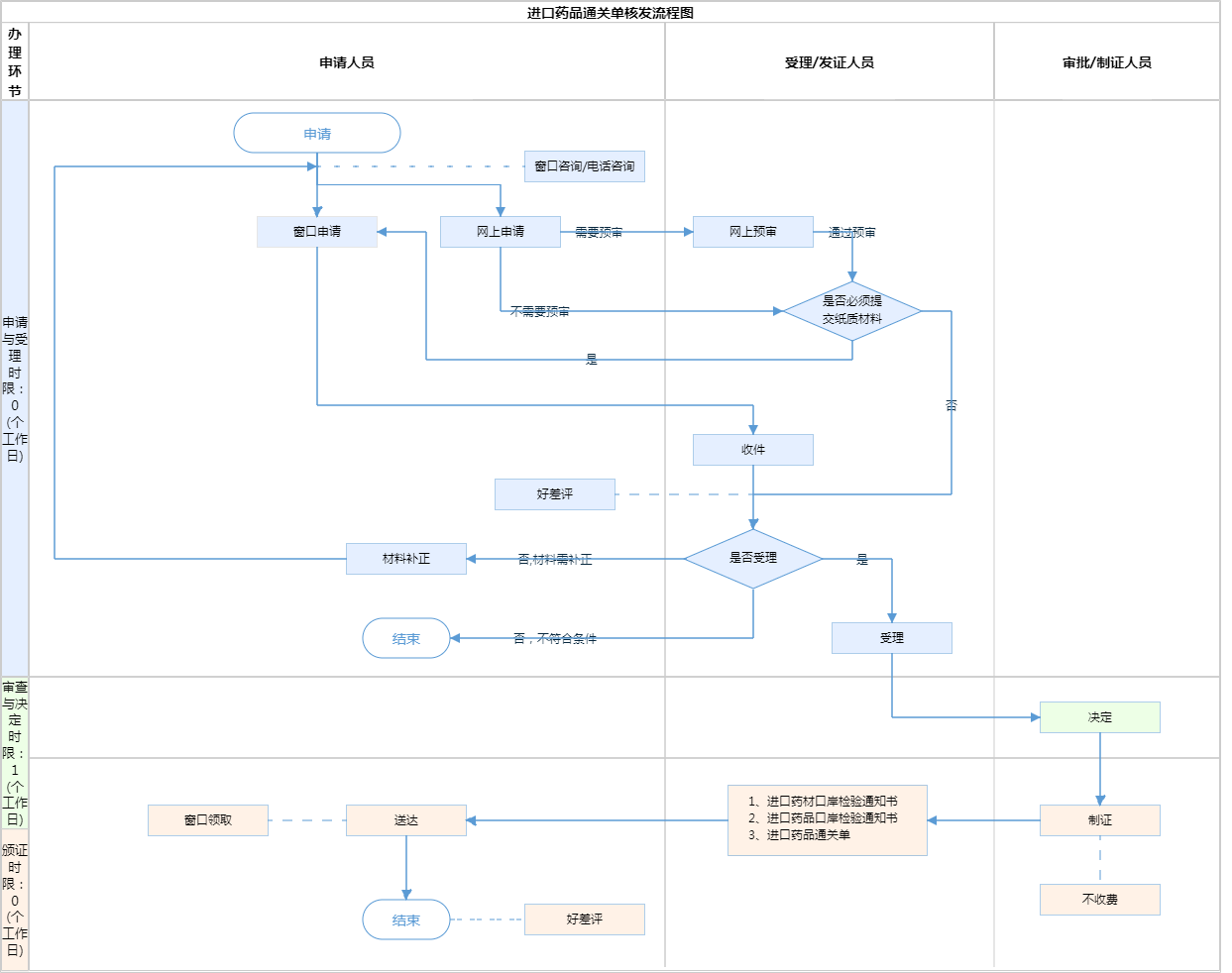
办理流程
流程文字说明
1、受理(时限:0个工作日)
办理结果:即时办理。
2、决定(时限:1个工作日)
办理结果:申请单位在网上申请端收到领取《进口药品通关单》的通知后,需携带相关进口药品(含药材)合法身份证明性文件原件至市政务服务中心通关备案窗口现场领取纸质《进口药品通关单》和《进口药品口岸检验通知书》。
3、发证(时限:0个工作日)
办理结果:进口药材口岸检验通知书;进口药品口岸检验通知书;进口药品通关单。
申请材料
3、药品经营许可证或药品生产许可证;
4、营业执照;
6、购货合同;
7、装箱单;
8、提运单;
9、货运发票;
10、出厂检验报告;
11、药品说明书及包装、标签的式样;
12、经其他国家(地区)转口的进口药品,应当同时提交产地到各转口地的全部购货合同;
13、经其他国家(地区)转口的进口药品,应当同时提交产地到各转口地的全部装箱单;
14、经其他国家(地区)转口的进口药品,应当同时提交产地到各转口地的全部提运单;
15、经其他国家(地区)转口的进口药品,应当同时提交产地到各转口地的全部货运发票;
16、(国家药品监督管理局规定批签发的生物制品,需要)生产检定记录摘要;
17、(国家药品监督管理局规定批签发的生物制品,需要)生产国家或者地区药品管理机构出具的批签发证明批签发材料;
18、申报材料真实性自我保证声明;
19、法定代表人授权委托书;
20、原产地证书;
21、药材标准及标准来源;
22、装箱单;
23、提运单;
24、货运发票;
25、(经其他国家(地区)转口的进口药材,应当同时)产地到各转口地的全部购货合同;
26、(经其他国家(地区)转口的进口药材,应当同时)产地到各转口地的全部装箱单;
27、(经其他国家(地区)转口的进口药材,应当同时)产地到各转口地的全部提运单;
28、(经其他国家(地区)转口的进口药材,应当同时)产地到各转口地的全部货运发票;
29、(进口药材涉及《濒危野生动植物种国际贸易公约》限制进出口的濒危野生动植物的,还应当)国家濒危物种进出口管理机构核发的《允许进出口证明书》;
30、(办理首次进口药材备案的,除上述规定资料外,还应当)进口药材批件;
31、(办理首次进口药材备案的,除上述规定资料外,还应当)进口药材补充申请批件(如有);
32、(办理非首次进口药材备案的,除上述规定资料外,还应当)进口单位的药品生产许可证或药品经营许可证;
33、(办理非首次进口药材备案的,除上述规定资料外,还应当)供货方合法资质证明性文件;
34、(办理非首次进口药材备案的,除上述规定资料外,还应当)购货合同;
35、(办理非首次进口药材备案的,除上述规定资料外,还应当)购货合同公证文书;
36、(进口单位为中成药上市许可持有人的,应当)药品批准文件;
37、(进口单位为中成药上市许可持有人的,应当)申报材料真实性自我保证声明;
38、(进口单位为中成药上市许可持有人的,应当)法定代表人授权委托书。
特殊情形
进口列入国家药品监督管理局公布的非药用物品目录中物质:
1、营业执照;
2、装箱单;
3、提运单;
4、货运发票;
5、出厂检验报告;
6、(进口尚未包含在目录中的非药用物品的)进口单位可持国家药品监督管理局进口批准文件及上述材料。
进口药品质量标准复核和临床研究所需标准品、样品和对照品:由注册申请人提交:
1、药品检验通知单或国家药品监督管理局同意开展临床试验的文件;
2、报验单位合法资质文件;
3、装箱单;
4、提运单;
5、货运发票;
6、出厂检验报告;
进口单位应在取得《进口药品通关单》15天内报关,如因客观原因延误报关的,需报送以下材料:
1、进口药品通关单。
涉及捐赠药品的,在进口药品通关单核发所需申请资料的基础上另需提交:
1、捐赠药品进口备案的书面申请;
2、社会组织信息或中华人民共和国组织机构代码证;
3、合法资质凭证;
4、捐赠协议。
结果样本



常见问题
问题1:办理进口药品通关单是否一定需要出厂检验报告书的复印件?
答:研制过程中所需研究用对照药品一次性进口可不需要提供出厂检验报告书的复印件。
本办事指南摘自药监局官网,如有变动,以官方发布为准。