2023年度广东省医疗器械注册工作报告
药监头条 广东省
2023年,广东省药品监督管理局(以下简称省药监局)深入贯彻国家药品监督管理局(以下简称国家药监局)和省委省政府决策部署,围绕药品监管综合改革总体要求,深化审评审批改革和“放管服”改革,落实大湾区药械监管创新政策,助力广东省医疗器械产业高质量发展,取得了一定的工作成效。
一、广东省注册工作情况
(一)产业总体情况
广东省医疗器械产业继续保持平稳较快发展,产品品类较为齐全,其中医学影像设备、监护设备、临床检验设备、体外诊断试剂等全国领先,产业规模超2800亿,主营为医疗器械的A股上市企业共29家。截至年底,全省共有有效一类产品备案凭证19888张,二类注册证14642张,三类注册证2124张;全省共有一类生产备案凭证3103张,二三类生产许可证3017张,全省共有医疗器械生产企业5060家。全年完成二类医疗器械(含体外诊断试剂)首次注册2223件,延续注册1159件,变更注册1009件,变更备案3697件。全年共有9家企业9个产品获得国家药监局创新医疗器械认定,5家企业5个产品按照国家药监局创新审批程序获批上市,1家企业1个产品进入国家药监局优先审批程序。
(二)审评审批改革主要工作情况
省药监局印发《关于优化第二类医疗器械注册审评审批的若干措施》(以下简称《若干措施》)以来,着力优化注册全链条全流程,在完善机制、规范标准、提升效率、优化服务等方面成效显著,初步形成高效高质的医疗器械注册审评审批体系,企业切实得到更加高效的服务,审评审批质量和效率得到明显提升。
加强对重组胶原蛋白敷料、医疗美容仪器等新兴医疗器械的支持力度。组织开展产业发展专题调研,召开注册申报研讨会,解读宣贯行业标准、注册审查指导原则等技术文件,集中解答有关产品类别判定、技术要求编制、灭菌消毒工艺研究、原材料质量控制、稳定性研究以及临床评价等热点和难点问题,助力新兴医疗器械产业发展。
推进新版GB 9706系列标准实施工作。加大政策宣贯力度,在广州、深圳、东莞、佛山、中山等有源医疗器械注册人集中地开展培训班,详细解读新版GB 9706系列标准修订重点、实施政策、检验送检要求、审评关注点等内容。制定出台优化新版GB 9706系列标准检验及审评审批有关政策,鼓励医疗器械注册人备案人提前实施新版标准,督促注册人根据产品注册证有效期、新版标准适用情况、检验工作预期完成情况等,适时开展产品注册工作。
医疗器械唯一标识试点工作取得新成效。全面推进广东省医疗器械唯一标识试点工作,探索从源头生产到临床应用全链条联动,开展第一、二批唯一标识实施情况评估。配合国家局信息中心、国家医保编码协会对省内的生产企业、医疗机构医疗器械唯一标识赋码与医保耗材分类与代码衔接应用情况、院内系统两码衔接与追溯应用情况开展调研。积极推广广东经验,中山大学附属第一医院《基于UDI的共享平台搭建与智慧精细化管理》入选国家局2023年智慧监管典型案例,深圳市局《深圳实施医疗器械唯一标识——助力监管和追溯》成功入选国际GS1医疗卫生2023年优秀案例。
二、广东省第二类医疗器械注册申请受理情况
(一)整体情况
2023年,省药监局依职责受理第二类医疗器械首次注册、延续注册、变更注册和变更备案申请共计8985件,比2022年增加40.61%。其中,医疗器械注册申请5335件,体外诊断试剂注册申请3650件。
按注册类型分,首次注册申请2362件,占全部第二类医疗器械注册申请的26.29%;延续注册申请1327件,占全部第二类医疗器械注册申请的14.77%;变更注册申请1599件,占全部第二类医疗器械注册申请的17.8%;变更备案申请3697件,占全部第二类医疗器械注册申请的41.14%。注册申请受理情况见图1,类型分布比例情况见图2。
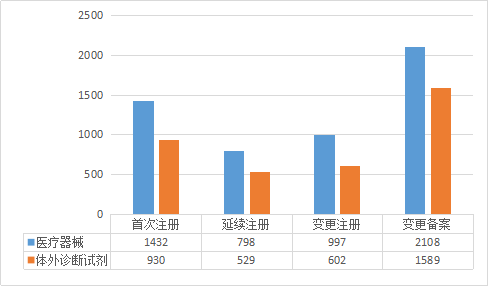
图1 注册申请受理情况
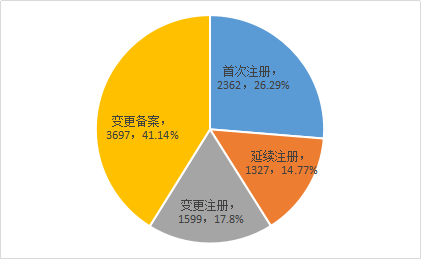
图2 注册申请受理注册类型分布比例图
(二)注册申请各地市分布情况
2023年,广东省第二类医疗器械注册申请受理各地市分布情况见表1。
表1 第二类医疗器械注册申请受理各地市分布情况(单位:件)
地区 | 深圳 | 广州 | 珠海 | 佛山 | 中山 | 东莞 | 惠州 | 江门 | 汕头 | 湛江 | 茂名 |
数量 | 4715 | 2152 | 531 | 494 | 425 | 295 | 93 | 55 | 40 | 38 | 26 |
地区 | 梅州 | 清远 | 揭阳 | 肇庆 | 河源 | 韶关 | 汕尾 | 横琴 | 潮州 | 阳江 | 云浮 |
数量 | 24 | 20 | 14 | 14 | 14 | 9 | 9 | 7 | 6 | 4 | 0 |
(三)首次注册受理各地市分布情况
2023年,广东省第二类医疗器械首次注册申请受理各地市分布情况见表2。
表2 第二类医疗器械首次注册申请受理各地市分布情况(单位:件)
地区 | 深圳 | 广州 | 佛山 | 珠海 | 东莞 | 中山 | 江门 | 惠州 | 清远 | 河源 | 湛江 |
数量 | 1132 | 592 | 157 | 152 | 103 | 75 | 31 | 31 | 19 | 11 | 11 |
地区 | 汕头 | 梅州 | 茂名 | 汕尾 | 肇庆 | 横琴 | 揭阳 | 韶关 | 阳江 | 潮州 | 云浮 |
数量 | 10 | 8 | 6 | 6 | 5 | 4 | 4 | 3 | 1 | 1 | 0 |
三、广东省第二类医疗器械注册审批情况
(一)整体情况
2023年,省药监局批准第二类医疗器械首次注册、延续注册、变更注册和变更备案共计8088件,比2022年增加14.14%。其中,医疗器械4812件,体外诊断试剂3276件。
按注册类型区分,首次注册2223件,比2022年增加6.57%;延续注册1159件,比2022年减少28.28%;变更注册1009件,比2022年减少14.92%;变更备案3697件,比2022年增加68.20%。近八年广东省批准第二类医疗器械注册情况见图3。

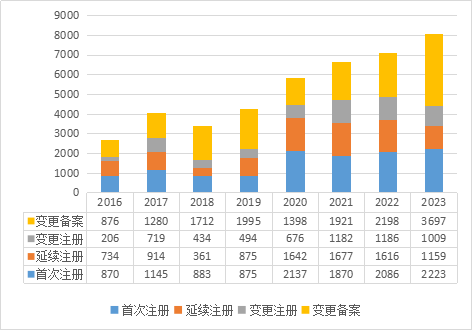
图3 2016至2023年度广东省第二类医疗器械注册数据图
(二)各地市第二类医疗器械注册证情况
1.各地市实有第二类医疗器械注册证情况
2023年,各地市实有第二类医疗器械注册证情况见表3。
表3 各地市实有第二类医疗器械注册证情况(单位:张)
地区 | 深圳 | 广州 | 珠海 | 佛山 | 东莞 | 中山 | 惠州 | 江门 | 汕头 | 湛江 | 揭阳 |
数量 | 6906 | 3361 | 976 | 887 | 719 | 683 | 237 | 184 | 131 | 90 | 83 |
地区 | 茂名 | 梅州 | 河源 | 清远 | 肇庆 | 汕尾 | 潮州 | 韶关 | 阳江 | 云浮 | 横琴 |
数量 | 65 | 59 | 48 | 43 | 43 | 32 | 29 | 26 | 18 | 9 | 3 |
2.各地市新增第二类医疗器械注册证情况
2023年,各地市新增第二类医疗器械注册证情况见表4。
表4 各地市新增第二类医疗器械注册证情况(单位:张)
地区 | 深圳 | 广州 | 佛山 | 珠海 | 东莞 | 中山 | 惠州 | 江门 | 清远 | 汕头 |
数量 | 1128 | 485 | 172 | 167 | 92 | 64 | 31 | 27 | 11 | 9 |
地区 | 河源 | 揭阳 | 梅州 | 肇庆 | 汕尾 | 茂名 | 湛江 | 韶关 | 横琴 | / |
数量 | 7 | 6 | 5 | 5 | 5 | 4 | 2 | 2 | 1 | / |
(三)首次注册审批数量前五品种
2023年,省药监局共批准第二类有/无源类医疗器械首次注册共1357件,按医疗器械产品分类目录统计,注册证数量排名前五位的产品分类目录分别是:注输、护理和防护器械,口腔科器械,医用成像器械,临床检验器械,医用诊察和监护器械合计847张,占比62.42%,见图4所示。
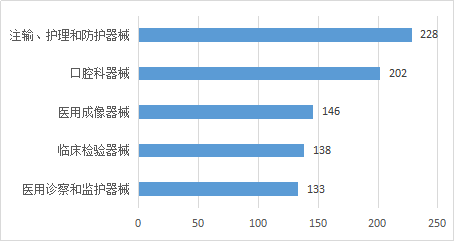
图4 首次注册第二类有/无源医疗器械审批数量前五位
四、创新医疗器械注册审批情况
2023年,省药监局按照创新医疗器械审查程序继续做好创新产品、第二类创新产品的审查工作,有9个产品获得国家药监局认定创新医疗器械,有12个产品获省药监局认定第二类创新医疗器械,如表5、表6所示。
表5 2023年度进入国家药监局创新审批项目
序号 | 产品名称 | 申请人 |
1 | 肝脏灌注系统 | 奇点医疗科技(广州)有限公司 |
2 | 导航定位微波消融系统 | 真健康(珠海)医疗科技有限公司 |
3 | 心腔内超声成像系统 | 深圳市赛禾医疗技术有限公司 |
4 | 介入式心室辅助设备 | 深圳核心医疗科技股份有限公司 |
5 | 脉冲电场消融设备 | 深圳迈微医疗科技有限公司 |
6 | 光固化创面封闭胶 | 中山光禾医疗科技有限公司 |
7 | 人DNA甲基化检测试剂盒(可逆末端终止测序法) | 广州燃石医学检验所有限公司 |
8 | 消化内镜手术辅助操作系统及配套用一次性使用消化内镜手术柔性臂 | 深圳市罗伯医疗科技有限公司 |
9 | 经心尖二尖瓣腱索修复系统 | 瀚芯医疗科技(深圳)有限公司 |
表6 2023年度进入省药监局创新审批项目
序号 | 产品名称 | 申请人 |
1 | 智能输液监护系统 | 广州点滴健康科技有限公司 |
2 | 经导管血液定量采注器 | 昊朗科技(佛山)有限公司 |
3 | 一次性使用可视胃肠营养导管 | 广州市如本生物科技有限公司 |
4 | 一次性使用无菌包皮扩张器 | 广州源临医疗器械有限公司 |
5 | 生殖道光学干涉断层成像系统 | 广州永士达医疗科技有限责任公司 |
6 | 人再生胰岛衍生蛋白1α(REG1A)测定试剂盒(酶联免疫法) | 深圳市盛波尔生命科学技术有限责任公司 |
7 | 磁牵引术野暴露系统 | 赛德欧科技(深圳)有限公司 |
8 | 碳青霉烯酶联合检测试剂盒(胶体金免疫层析法) | 广东聚诚生物技术有限公司 |
9 | 电子耳鼻喉内窥镜 | 深圳市医创生物科技有限公司 |
10 | 无感睡眠监测仪 | 深圳市华屹医疗科技有限公司 |
11 | 人体磁感应睡眠状态评估仪 | 广州杜工智能健康科技发展有限公司 |
12 | 微型气相色谱仪 | 精智未来(广州)智能科技有限公司 |
2023年,国家药监局批准广东省5个创新医疗器械上市,省药监局批准4个第二类创新医疗器械上市,如表7所示。
表7 2023年度广东省批准上市的创新医疗器械
序号 | 产品名称 | 申请人 | 批准机构 |
1 | 病人监护仪 | 深圳市科曼医疗设备有限公司 | 国家药监局 |
2 | 结肠息肉电子内窥镜图像辅助检测软件 | 腾讯医疗健康(深圳)有限公司 | 国家药监局 |
3 | 植入式左心室辅助系统 | 深圳核心医疗科技有限公司 | 国家药监局 |
4 | 冲击波治疗仪 | 深圳市慧康精密仪器有限公司 | 国家药监局 |
5 | 腹腔内窥镜单孔手术系统 | 深圳市精锋医疗科技股份有限公司 | 国家药监局 |
6 | 牵引功能锻炼颈托 | 佛山市乙太医疗用品有限公司 | 省药监局 |
7 | L-酪氨酸和牛磺胆酸测定试剂盒(液相色谱-串联质谱法) | 深圳市绘云生物科技有限公司 | 省药监局 |
8 | 光学三维人体背部测量系统 | 深圳市易尚康瑞技术有限公司 | 省药监局 |
9 | 骨导式助听器 | 深圳市韶音科技有限公司 | 省药监局 |
五、广东省第三类医疗器械注册情况
(一)第三类医疗器械注册审批情况
2023年,广东省新增第三类医疗器械注册证319张,居全国第二。2021至2023年度各省新增第三类医疗器械注册数量见表8。
表8 2021-2023年度新增第三类医疗器械注册数量各省分布情况(单位:件)
地区/ 年份 | 2021 | 2022 | 2023 | 地区/ 年份 | 2021 | 2022 | 2023 | 地区/ 年份 | 2021 | 2022 | 2023 |
北京 | 163 | 254 | 272 | 安徽 | 5 | 16 | 35 | 贵州 | 1 | 0 | 0 |
天津 | 55 | 84 | 79 | 福建 | 49 | 58 | 82 | 云南 | 1 | 3 | 7 |
河北 | 14 | 18 | 31 | 江西 | 16 | 16 | 29 | 重庆 | 8 | 42 | 23 |
山西 | 1 | 2 | 1 | 山东 | 88 | 122 | 144 | 西藏 | 0 | 0 | 0 |
内蒙古 | 0 | 1 | 0 | 河南 | 0 | 36 | 38 | 陕西 | 7 | 20 | 21 |
辽宁 | 8 | 11 | 26 | 湖北 | 23 | 29 | 41 | 甘肃 | 6 | 2 | 6 |
吉林 | 11 | 8 | 17 | 湖南 | 15 | 33 | 41 | 青海 | 0 | 0 | 1 |
黑龙江 | 0 | 2 | 0 | 广东 | 192 | 319 | 319 | 宁夏 | 0 | 0 | 0 |
上海 | 116 | 174 | 181 | 广西 | 0 | 3 | 2 | 新疆 | 0 | 0 | 0 |
江苏 | 209 | 395 | 430 | 海南 | 28 | 4 | 6 | 兵团 | 0 | 0 | 0 |
浙江 | 84 | 145 | 212 | 四川 | 31 | 47 | 34 | / | / | / | / |
数据来源:国家药监局。
(二)各地市第三类医疗器械注册情况
1.各地市实有第三类医疗器械注册证情况
2023年,各地市实有第三类医疗器械注册证情况见表9。
表9 各地市实有第三类医疗器械注册证情况(单位:张)
地市/类别 | 有/无源 | 体外诊断试剂 | 总数 |
深圳 | 763 | 352 | 1115 |
广州 | 175 | 345 | 520 |
珠海 | 102 | 82 | 184 |
佛山 | 112 | 3 | 115 |
中山 | 19 | 38 | 57 |
东莞 | 68 | 1 | 69 |
江门 | 18 | 0 | 18 |
汕头 | 6 | 0 | 6 |
潮州 | 0 | 12 | 12 |
惠州 | 10 | 0 | 10 |
揭阳 | 7 | 0 | 7 |
湛江 | 5 | 0 | 5 |
梅州 | 4 | 0 | 4 |
总数 | 1289 | 833 | 2122 |
2.各地市新增第三类医疗器械注册证情况
2023年,各地市新增第三类医疗器械注册证情况见表10。
表10 各地市新增第三类医疗器械注册证情况(单位:张)
地市/类别 | 有/无源 | 体外诊断试剂 | 总数 |
深圳 | 152 | 36 | 188 |
广州 | 25 | 35 | 60 |
佛山 | 17 | 1 | 18 |
东莞 | 19 | 0 | 19 |
珠海 | 23 | 2 | 25 |
中山 | 3 | 0 | 3 |
汕头 | 2 | 0 | 2 |
梅州 | 0 | 2 | 2 |
潮州 | 0 | 2 | 2 |
总数 | 241 | 78 | 319 |
(三)第三类医疗器械注册证数量前五品种
2023年,按医疗器械分类目录统计,广东省实有第三类有/无源医疗器械注册证数量排名前五的情况见表11。
表11 广东省实有第三类有/无源医疗器械注册证数量(单位:张)
序号 | 分类目录 | 注册证数 |
1 | 03神经和心血管手术器械 | 251 |
2 | 14注输、护理和防护器械 | 186 |
3 | 06医用成像器械 | 147 |
4 | 13无源植入器械 | 113 |
5 | 08呼吸、麻醉和急救器械 | 109 |
2023年,广东省新增第三类有/无源医疗器械注册品种按分类目录统计,总数排名前五的情况见表12。
表12 广东省新增第三类有/无源医疗器械注册品种数量(单位:张)
序号 | 分类目录 | 注册证数 |
1 | 03神经和心血管手术器械 | 58 |
2 | 17口腔科器械 | 38 |
3 | 08呼吸、麻醉和急救器械 | 29 |
4 | 14注输、护理和防护器械 | 25 |
5 | 10输血、透析和体外循环器械 | 16 |
六、临床试验相关工作开展基本情况
2023年,广东省新增医疗器械临床试验备案机构17家,截至2023年底,医疗器械临床试验备案机构总数达139家。
2023年,省药监局办理新增医疗器械临床试验备案项目579个,其中境内第三类353个,境内第二类217个,进口第三类3个,进口第二类6个。
七、医疗器械注册优先审批基本情况
2023年,广东省有1个产品进入国家药监局优先审批程序,有9个产品进入省药监局优先审批程序,如表13、表14所示。
表13 2023年度进入国家药监局优先审批程序项目
序号 | 产品名称 | 申请人 |
1 | 人类免疫缺陷病毒(HIV 1/2)抗体检测试剂(免疫层析法) | 广州万孚生物技术股份有限公司 |
表14 2023年度进入省药监局优先审批程序项目
序号 | 产品名称 | 申请人 |
1 | 全数字彩色多普勒超声诊断系统 | 汕头市超声仪器研究所股份有限公司 |
2 | 白介素6(IL-6)测定试剂盒(化学发光免疫分析法) | 深圳迈瑞生物医疗电子股份有限公司 |
3 | 白介素6校准品 | 深圳迈瑞生物医疗电子股份有限公司 |
4 | 白介素6质控品 | 深圳迈瑞生物医疗电子股份有限公司 |
5 | 全自动血气、电解质和代谢物分析仪 | 深圳市理邦精密仪器股份有限公司 |
6 | 血气、电解质和代谢物测定试剂盒 (电极法) | 深圳市理邦精密仪器股份有限公司 |
7 | 血气、电解质和代谢物定标液 | 深圳市理邦精密仪器股份有限公司 |
8 | 高敏心肌肌钙蛋白I(hs-cTnI)测定试剂盒(化学发光免疫分析法) | 深圳迈瑞生物医疗电子股份有限公司 |
9 | 氨基末端脑利钠肽前体(NT-proBNP)测定试剂盒(化学发光免疫分析法) | 深圳迈瑞生物医疗电子股份有限公司 |
注:本报告的数据统计截至2023年12月31日。






















