关于公开征求《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》申报指南和实施框架意见的通知
政策公告 全国
“关爱计划”(CARE计划,patient-Centered Action for Rare diseases Encouragement)是一项在罕见疾病药物研发领域落实“以患者为中心”理念的试点工作,旨在指导和帮助研发单位在药物研发全程充分倾听患者声音,提升“将患者体验数据整合入罕见疾病药物临床研发”的科学性、规范性及合理性,并在此过程中增强监管机构、药物研发单位和患者等专注于罕见疾病药物研发的各方沟通与协作,进而高质高效推动罕见病药物研发和上市,满足迫切的临床需求。
我中心起草了《以患者为中心的罕见疾病药物研发试点工作计划 (“关爱计划”)》,现对该试点工作计划的申报指南和实施框架公开征求意见。我们诚挚地欢迎社会各界提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:唐凌,徐小文
联系方式:tangl@cde.org.cn, xuxw@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2024年5月24日
以患者为中心的罕见疾病药物研发试点工作计划——“关爱计划”
“关爱计划”是为了推动以患者为中心的药物研发,落实国家药监局关于加快推动罕见疾病用药的工作部署而在罕见疾病药物研发领域开展的一项试点工作。关爱计划旨在坚持“以患者为中心”的药物研发理念,鼓励药物研发单位在罕见疾病药物研发过程中倾听患者声音,关注患者的体验与感受。
一、背景
目前全球已知的罕见疾病超过7000种。罕见疾病发病率/患病率极低,病情复杂,目前对其认识相对有限,加剧了罕见疾病药物研发难度。
当前,“以患者为中心”的药物研发理念逐步被广泛接受。对于罕见疾病药物而言,在研发过程中,落实“以患者为中心”的药物研发理念,关注患者视角,倾听患者声音,将有助于药物研发企业、研究者、监管机构了解罕见疾病,了解患者需求,从而助力于对此类药物研发的科学流程及技术要求的优化。
为此,药审中心启动以患者为中心的罕见疾病药物研发试点工作,即“关爱计划(”CARE计划,patient-Centered Action for Rare diseases Encouragement)。
“关爱计划”旨在指导申请人在药物研发的全程,引入罕见疾病患者的观点,提升将与药物临床获益-风险评价相关的患者体验整合入罕见疾病药物临床研发中的科学性、规范性及合理性,并在此过程中增强监管机构、药物研发单位、患者等专注于罕见疾病药物研发的各方沟通与协作,最终促进罕见疾病药物的上市,满足临床需求。
二、主要内容
“关爱计划”是一项旨在罕见疾病药物研发领域落实以患者为中心的药物研发理念的试点工作。
《以患者为中心的罕见疾病药物研发试点工作(“关爱计划”)实施框架》(以下简称“实施框架”)是“关爱计划”的配套文件。实施框架将药物研发为5个阶段,覆盖药物研发的全生命周期,具体包括:A阶段:研发立项阶段;B阶段:临床试验开展前(Pre-IND)阶段;C阶段:关键研究前阶段;D阶段:上市申请前/上市申请(Pre-NDA/NDA)阶段;E阶段:上市后阶段。实施框架中详细介绍了不同的研发阶段可以开展的、体现“以患者为中心”的研发理念的工作内容和具体实施方法,主要包括在不同阶段如何收集符合该研发阶段需要的患者体验数据、如何将这些数据应用于药物研发过程中、以及如何实施兼顾患者体验的临床试验。
三、组织与实施
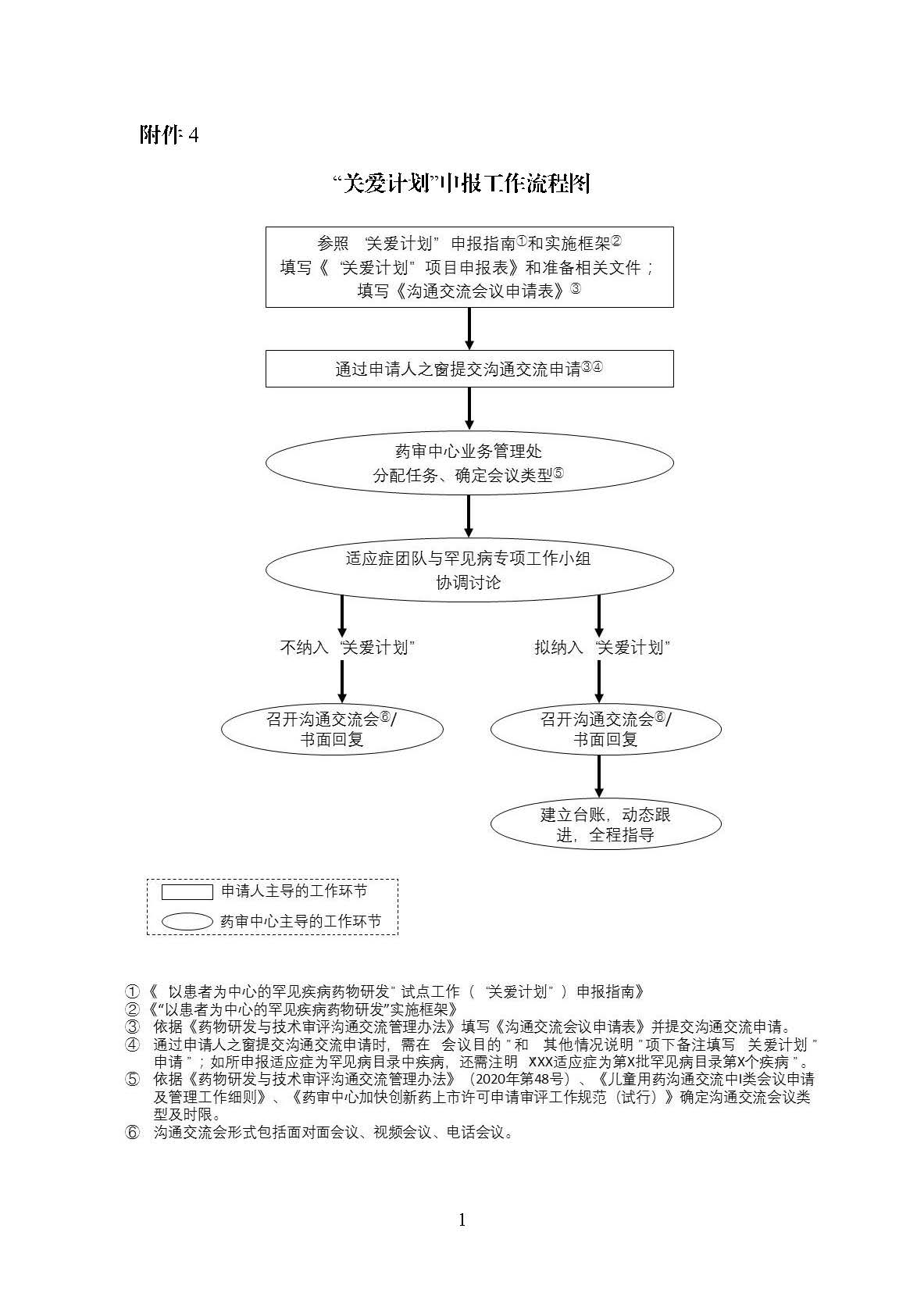
药审中心起草了“关爱计划”的申报指南(见附件1)和实施框架(见附件2),详细介绍了申请加入“关爱计划”的方法和具体要求,供有意向申请加入“关爱计划”的申请人参考。申请人基于自愿原则通过沟通交流途径,根据药物所处的研发阶段,申请加入“关爱计划”中相应的阶段,药审中心在A、B、C、D、E各阶段选择1-2个具有代表性的品种纳入“关爱计划”。纳入试点项目的品种需根据实施框架中的要求开展和完成所对应阶段相关的工作。申请人在依据现行法规和工作程序开展常规的药物申报及注册工作的同时,还需向中心汇报实施框架中所要求的相关工作进展或结果。
申请人可通过沟通交流途径向中心递交加入“关爱计划”的申请。药审中心将结合产品特点、所开发/申报的适应症情况、以及申请人所提交的实施计划等,中心罕见疾病工作组和相应适应症团队对是否同意其纳入“关爱计划”进行评价,必要时将召开沟通交流会,就实施计划的细节予以讨论。
经评价拟同意纳入“关爱计划”后,药审中心将予以公示,公示期为5日,公示无异议的品种最终将纳入“关爱计划”。
“关爱计划”的申报流程见附件4。
附件:1.以患者为中心的罕见疾病药物研发试点工作(“关爱计划”)申报指南(征求意见稿)
2.以患者为中心的罕见疾病药物研发试点工作(“关爱计划”)实施框架(征求意见稿)
3."关爱计划"项目申报表
4."关爱计划"申报工作流程图