关于公开征求《可吸收性外科缝线同品种临床评价注册审查指导原则(征求意见稿)》等3项医疗器械注册审查指导原则意见的通知
法规 全国

各有关单位:
根据国家药品监督管理局2022年度医疗器械注册审查指导原则制修订计划的有关要求,我中心组织编制了《可吸收性外科缝线同品种临床评价注册审查指导原则》等3项医疗器械注册审查指导原则,经调研、讨论,现已形成征求意见稿(附件1-3),即日起在网上公开征求意见。
如有意见和建议,请填写意见反馈表(附件4),以电子邮件的形式于2023年7月19日前反馈至我中心相应联系人。邮件主题及文件名称请以“《XX注册审查指导原则(征求意见稿)》意见反馈+反馈单位名称”格式命名。
联系人及方式:
1.可吸收性外科缝线同品种临床评价注册审查指导原则(征求意见稿)
联系人:孟颖
电话:010-86452504
电子邮箱:mengying@cmde.org.cn
2.人工智能辅助检测医疗器械临床评价注册审查指导原则(征求意见稿)
联系人:王泽华
电话:010-86452521
电子邮箱:wangzh@cmde.org.cn
3.一次性使用血液透析器临床评价注册审查指导原则(征求意见稿)
联系人:邱宏
电话:010-86452505
电子邮箱:qiuhong@cmde.org.cn
附件:
1.可吸收性外科缝线同品种临床评价注册审查指导原则(征求意见稿)
2.人工智能辅助检测医疗器械临床评价注册审查指导原则(征求意见稿)
3.一次性使用血液透析器临床评价注册审查指导原则(征求意见稿)
4.反馈意见表
国家药品监督管理局
医疗器械技术审评中心
2023年6月21日
可吸收性外科缝合线同品种临床评价注册审查指导原则(征求意见稿)
本指导原则旨在指导注册申请人对高分子合成可吸收性外科缝合线开展同品种比对临床评价,同时也为技术审评部门审评高分子材料合成可吸收性外科缝合线同品种比对临床评价资料提供参考。
本指导原则是对高分子合成可吸收性外科缝合线同品种临床评价的一般要求,申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,需在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则的相关内容也将进行适时的调整。
一、适用范围
本指导原则适用于高分子合成材料制成的可吸收性外科缝合线,通常用于一般软组织缝合。涵盖的材料包括聚乙醇酸(PGA)、乙交酯-丙交酯共聚物(PGLA)、聚对二氧环己酮(PDO)等可吸收合成材料等。常规的缝线可以是单股或多股形式,可设计为免打结的带倒刺缝线,亦可设计为不带倒刺的普通可吸收缝线,可用合适的涂层、软化剂浸渍或处理。按现行《医疗器械分类目录》,可吸收外科缝线分类编码为02-13-06,管理类别为III类。
本导则不适用于具有全新的技术特性(如采用了全新的工作原理、技术、材质及其比例、结构设计、加工处理方式、表面处理/涂层、使用方式等),或具有全新的临床适用范围。本指导原则不适用于三氯生等抗菌涂层缝线、YY1116《可吸收性外科缝线》标准中的I类缝线(可吸收动物源性)和DNA重组技术生产的可吸收外科缝线等。
二、同品种临床评价的基本要求
(一)同品种医疗器械的选择
注册申请人需选择与申报产品适用范围相同,技术特征最为相似的产品作为同品种医疗器械。技术特征一般包含材质及其比例、结构设计、表面处理/涂层、降解性能、力学性能等。必要时可选择多个同品种器械进行对比。
(二)适用范围及临床使用相关信息的对比
申报产品与同品种器械适用范围需相同,通常表述为“用于适合使用可吸收缝线的软组织缝合”。同时,申请人可根据产品设计特征及临床使用情形,需明确不适用的组织类型或科室类型,如心血管、神经、眼科等,同时需针对以下信息进行重点比对:
1. 适用的组织类型:如皮肤、肌肉、胃肠道等
2. 使用方法:如是否免打结、一次性使用、预期组织接触时间等。
3. 禁忌证及注意事项:包括不可使用该缝线的手术类型、身体部位或患者人群。如:不适用于心血管和神经组织的缝合或结扎及在张力下的长期(超过六周)组织缝合;不可用于不可吸收的人工假体装置(如人造心脏瓣膜或人工合成的移植物)的连接或固定;本产品不适用于美容提拉手术;本产品不适用于眼部缝合;本产品不适用于会阴部位缝合。
(三)技术特征的对比
注册申请人需比对申报产品与同品种的技术特征,包括但不限于:
1. 结构组成
(1)组成成分的对比包括主要材料及添加剂、涂层及各成分百分比、染色情况(明确成分及符合的标准)、鉴于可吸收性外科缝线的制造材料是影响终产品力学性能、降解时间及产物的重要因素之一,若已知同品种各材料的商品名、CAS号、化学结构式/分子式、平均分子量、分子量范围及分布、特性粘度、纯度、单体残留、使用量或组成比例、红外及核磁鉴别等信息,建议以列表形式进行对比。若缝线带针应注明针材质、是否带有涂层等信息。
(2)结构设计,具体包括规格与直径、单股/多股、是否带针(针线连接方式)或其他附件(如垫片等)、倒刺成形及分布方式、倒刺长度、切刺深度及倒刺深度占原线径的比例、方向及角度等(如适用)。
2.物理性能
多数情况下,对于工艺成熟的如聚乙醇酸(PGA)、乙交酯-丙交酯共聚物(PGLA)、聚对二氧环己酮(PDO)可吸收性外科缝线,鉴于YY1116《可吸收性外科缝线》等相关标准中有明确接受阈值的性能要求,同品种比对时可不进行对比,申报产品的实测值符合相关标准要求即可,如外观、规格、与针线连接强度(带针缝线)、抗张强度、长度等项目。
对于标准中未规定的项目,需结合申报产品的设计及临床应用情况,补充相应性能指标的对比,若缝线尾端带有固定环,需对固定环与线的连接强度等进行比较。若缝线带有倒刺设计,需对比倒刺抓持力。若产品带有缝合针,建议对缝合针线径比等进行对比;若产品带有垫片,建议对垫片的材质、尺寸、预期使用部位等进行对比。
(四)生物学特性的对比
重点对比降解吸收特性:建议申请人阐明产品的降解吸收机理,通过体内研究(可参考《可吸收性外科缝线注册技术审查指导原则》)来对比论述申报产品和同品种产品的降解吸收特性能否满足临床使用。
对比的关键内容包括缝线的降解吸收速率,缝线质量、尺寸、降解周期、组织相容性、伤口愈合情况、组织抓持力随时间变化的曲线(倒刺缝线)、抗张强度随时间变化的曲线等。说明可吸收缝线的残留抗张强度的持续时间具有临床意义。具有临床意义的时间长度取决于缝线的预期用途。建议申请人指明吸收特性与预期用途(如组织缝合能力的保持时间、目标组织的愈合时间)的一致性。
申报产品与同品种产品进行对比验证时,需关注所选的规格型号是否可覆盖全部申报产品,所选的同品种产品相应测试规格是否具有可比性,如降解研究选择的缝线规格需能覆盖申请注册的最大、最小及中等线径的缝线规格进行研究,研究的缝线线径规格之间的差异不得超过两个规格。
(五)差异部分的安全有效性证据
注册申请人需基于上述信息的对比,充分识别产品的等同性及差异性,并提供证明差异部分可接受的支持性证据。
若申报产品与同品种的材料牌号、结构设计、技术特征参数基本一致,论证一致性后可不再额外提供组织缝合效果等动物试验。
若申报产品与同品种的缝线设计存在差异,需考虑进一步补充同品种医疗器械以论证申报产品设计与已上市产品的等同性。例如,申报产品为带倒刺设计缝线,但选择同厂家前代普通可吸收缝线作为同品种,针对该设计差异,建议补充材质、结构相同的倒刺缝线(单向倒刺、双向倒刺、螺旋倒刺等)作为同品种并进行各降解周期力学性能、动物缝合效果等比对测试。
若申报产品与同品种的材料名称一致,但牌号不一致,需在论证体内降解特性,力学行为一致的基础上,进一步观察动物不同组织缝合效果测试,论者差异部分未对临床使用的安全有效性带来不利影响。
开展动物缝合效果试验时,需采用可模拟外科缝线预期使用方式、使用部位的动物(如巴马猪),以进一步论证降解吸收特性满足临床使用要求。动物试验设计时重点考虑以下几点:
1. 试验选择典型手术部位、组织类型时,重点关注申报产品和同品种产品的缝线规格及各规格的缝合部位和组织类型。同时考虑不同部位的组织张力、组织愈合时间、组织反应性、内环境pH值(如胃肠道的酸性环境及胆道的碱性环境)等特点,选择典型组织类型,如皮肤、粘膜、筋膜、肌肉等,及典型的手术部位,以腹部为例,包括腹部皮肤、皮下组织、筋膜、腹壁肌层、胃肠壁等。
综上,试验选择的手术部位及组织类型需要能覆盖产品申报的临床适用范围。如申报特殊的组织部位,如眼科、心血管及神经外科等,需单独进行验证。
2. 观察时间需能覆盖具有临床意义的降解时间,而具有临床意义的降解时间周期取决于缝线的预期用途(如长期或短期降解产品对应的组织缝合能力等)。例如,目前PDO材质的缝线在临床上适用于需要长时间(可达6周)伤口支撑的部位,其降解周期通常达到20周以上。同时关注急性反应期的情况,如缝合1周。
3. 评价指标需包含术后不同时间点的伤口愈合情况,如愈合进度、有无伤口裂开、有无炎性渗出、感染、水肿、红斑、皮肤温度、浆液瘤、缝线窦等;皮肤缝合处生物力学强度测试;组织学反应;失效情况(如可吸收倒刺缝合线,除传统可吸收缝线随着降解吸收在张力下的断裂情形外,是否存在缝线抓持力降低,伤口裂开;倒刺线在组织上形成小的切口,缝合期间出现组织水肿、张力增大等问题或缝合较薄组织时,是否出现倒刺线划破甚至切割组织的情况)。
若申报产品的部分测试或研究结果差于同品种产品,需结合申报产品拟使用的临床情况、已上市同类产品的水平、申报产品的临床数据(如有)、临床诊疗要求等资料,综合分析论证该结果的临床可接受性。若无充分证据,需提供申报产品符合GCP要求的临床试验。
(六)同品种医疗器械的临床数据
建议参考《医疗器械临床评价技术指导原则》要求,提交同品种产品和申报产品的临床数据,临床数据包括临床试验或临床使用获得的数据,临床使用获得的数据可来自中国境内和/或境外公开发表的科学文献和合法获得的相应数据,包括临床文献数据、临床经验数据等。临床文献数据的收集需保证查准、查全文献,具有可重复性;临床经验数据收集需包括对已完成的临床研究、不良事件、与临床风险相关的纠正措施等数据的收集。申请人可依据产品的具体情形选择合适的数据来源和收集方法。
临床数据中如有缝线的规格型号、临床应用部位、缝合方式、伤口愈合情况、随访观察时间、不良事件及并发症等相关内容,建议列表分析。
可吸收性外科缝线常见相关不良事件及并发症包括(但不限于):缝线断裂、伤口裂开、异物反应引起的炎症、缝线吸收缓慢或不吸收、伤口愈合不良、感染等。
三、参考文献
[1]国家药品监督管理局.医疗器械临床评价技术指导原则:国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[2]国家药品监督管理局.医疗器械临床评价等同性论证技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[3]国家药品监督管理局.决策是否开展医疗器械临床试验技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[4]国家药品监督管理局.医疗器械注册申报临床评价报告技术指导原则(2021):国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告2021年第73号[Z] .
[5]原国家食品药品监督管理总局. 医疗器械临床试验设计指导原则(2018):原国家食品药品监督管理总局通告2018年第6号[Z].
[6]原国家食品药品监督管理总局. 原国家食品药品监督管理总局. 可吸收性外科缝线注册技术审查指导原则:国家食品药品监督管理总局通告2016年第7号[Z].
[7] 原国家食品药品监督管理总局.医疗器械分类目录: 原国家食品药品监督管理总局公告2017年第104号[Z].
[8] 国家药品监督管理局,国家卫生健康委员会.医疗器械临床试验质量管理规范: 国家药品监督管理局 国家卫生健康委员会2022年第28号[Z].
人工智能辅助检测医疗器械临床评价注册审查指导原则(征求意见稿)
本指导原则旨在指导注册申请人开展人工智能(artificial intelligence,AI)辅助检测类医疗器械临床评价的资料准备,同时为技术审评部门审评人工智能辅助检测类产品临床评价资料提供参考。
本指导原则进一步明确人工智能辅助检测类医疗器械临床评价的要求和适用情形。申请人可依据产品的具体特征确定其中内容是否适用,若不适用,需阐述理由并提供相应的科学依据,并依据产品的具体特征对临床评价资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的合理性论述和验证确认资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
人工智能医疗器械从用途角度可分为辅助决策类和非辅助决策类。其中,辅助决策是指通过提供诊疗活动建议辅助医务人员进行临床决策,如通过异常识别、病灶性质判定、自动制定手术计划进行辅助分诊、辅助检测、辅助诊断、辅助治疗。
人工智能辅助检测产品,是指基于计算机人工智能算法,可包含模式识别和数据分析等功能,通过识别、标记、突出等方式提示医师关注可能的异常/病变区域,从而辅助临床医师做出相应诊疗决策的产品,分类编码为21-04-02,管理类别为第III类;产品还可同时包含非辅助决策功能,如结构化报告生成、前后片对比、正常组织的分割(如肺叶、肋骨等)、尺寸测量、CT值计算等临床功能和数据储存、传输等非临床功能等。人工智能辅助检测产品常见的有针对肺结节、乳腺结节、骨折、血管狭窄、结肠息肉等病变/异常的检出产品,本指导原则给出此类产品的通用要求,并以肺结节辅助检测和结肠息肉辅助检测产品为例(详见附录),阐述对人工智能辅助检测产品的临床试验中具体要素的考虑建议,同类型产品可参考相关适用部分。
本指导原则不适用于如下情形:1.可鉴别病变的性质(如良恶性)或疾病分期分型的人工智能辅助诊断类产品,2.预测疾病发生概率的产品,3.可同时辅助检测、鉴别诊断多种病变的多分类人工智能辅助检测产品(例如同时辅助检测并分类肺结节、条索、胸膜增厚、胸腔积液、肋骨骨折的产品);4.人工智能辅助分诊、转诊产品,此类产品对患者是否患有目标疾病,从而对患者的分诊转诊提供辅助决策建议的产品,该类产品不给出具体病变情况,且无论辅助分诊结果为阴性、阳性,均需专业医师再一次对患者影像进行评阅,常见的有糖尿病视网膜病变辅助分诊、肺炎辅助分诊、脑出血辅助分诊等;5. 配合体外诊断试剂产品使用的人工智能辅助分析软件。上述产品可参照本指导原则中适用部分的要求。
二、临床试验设计
(一)临床试验目的
临床试验目的一般是评价申报产品在预期适用范围下使用时的辅助检测诊断学性能,亦可一并观察产品的可用性与安全性。
(二)临床试验基本设计类型
人工智能辅助检测类产品的临床意义在于提升医师的病变检测准确度,为充分评估产品的临床受益风险可接受性,此类产品一般需考虑开展对照试验,根据产品特征及临床诊疗实际,可以为平行对照、交叉自身对照或多阅片者多数据样本(multiple reader multiple case,MRMC)试验设计。
试验组一般为医师在软件的辅助下完成异常/病变的检测,对照组一般为临床医师独立的异常/病变的检测,比较二者的诊断准确率。
(三)研究对象
1.预期人群的影像学样本
预期人群的影像学样本是人工智能辅助检测产品临床试验的典型研究对象,影像学样本可以基于定义明确的入选和排除标准收集,可为临床已有数据(如临床诊疗中产生的真实世界数据)。考虑到AI与医师观察、操作的协同交互等因素,基于实时影像的辅助检测临床试验宜基于阅片者前瞻性检查影像样本作为试验研究对象,而非采用过往既有的检查录像。
为了保证临床试验质量以及结果的可靠性,研究对象选取时,申请人需考虑如下措施:一是纳入数据样本独立于申报产品或前代产品开发所用数据集,如申报产品或前代产品的训练集、测试集。二是采用临床已有数据进行研究时,需基于明确且严格的入排标准和计划,收集过往某段时间内、特定医疗机构内患者影像学数据,避免主观挑选病例。三是考虑阳性数据样本中,目标疾病的疾病谱分布(如分型、分期)合理性,某些对辅助检测具有挑战性的分期、分型,必要时在临床试验中富集相关具有代表性的亚组。四是需避免在一项临床试验中同时入组同一患者的多组样本数据。五是临床已有数据收集时,需尽可能全面的收集与疾病相关的信息(适用的),具体包括但不限于:
(1)人口统计学信息(如年龄、性别);
(2)与辅助检测目标疾病相关的信息,如病史、疾病状态、分期、分型、病变大小、病变位置、器官特征(如乳腺成分)、伴随疾病等。
(3)确定为阳性/阴性病例的依据,如既往诊断结论,以及确定疾病状态、部位和程度的方法。
2.阅片者
由于阅片者表现的变异度及其与患者样本变异度和诊断方法(即AI辅助器械)之间的交互效应,一般情况下宜将阅片者列入研究对象。基于非实时影像的辅助检测产品(如肺结节/骨折/乳腺结节辅助检测等),采用MRMC设计可较好的控制阅片者偏倚,所需的样本量一般较少,申请人可优先考虑选择。采用MRMC设计时,根据预期的使用者情况,选取不同水平的多位医师作为阅片者,申请人需论述阅片者数量的合理性。
(四)评价指标
主要评价指标应结合产品设计特征和临床试验可行性进行综合选择,一般认为固有诊断准确性指标受样本患病率差异的影响较小,因此,在试验可行的前提下宜优先考虑此类指标作为主要评价指标。固有准确度指标包括敏感度、特异度、ROC或其衍生曲线等。
无论选择哪些指标作为主要评价指标,该类产品临床试验应当考虑整体的优效性设计,例如ROC或其衍生曲线下面积(Area Under Curve,AUC)的优效设计,或者目标疾病辅助检测的灵敏度优效和特异度非劣效,或者息肉/腺瘤初检检出率的优效性等。
(五)金标准构建
申请人应详述金标准的选择、构建方法及理由。可供选择的金标准构建方法包括:一是以临床已确认结果为金标准,即临床上结合患者影像学检查、病史、实验室检查(如活检)、长期随访结果等方法综合判定的临床诊断结果,基于前瞻数据或临床已有数据皆可;二是通过专家组对患者影像的阅片判定作为金标准。
对于人工智能辅助检测产品,通常可选择高年资医师组成的阅片专家组综合意见为金标准,并需要明确:1.专家数量;2.专家经验及专业水平;3.决策机制(如少数服从多数、背靠背第三人仲裁等);4.专家决策时所依据的信息(如图像上是否有标记,是否还提供了病史或其他检查结果等);5.判定所依据的临床准则(如临床指南、诊疗规范等)。
对于试验中对病灶的检出是否与金标准专家组意见一致,一般可考虑1.试验组/对照勾画病灶的中心在专家组勾画的病灶轮廓边界范围内;2.试验组/对照组勾画病灶与专家组勾画病灶的像素重合度高于一定比例;若采用其他判定方法,则需论述合理性。
若采用临床已确认结果作为金标准,则需明确1.已确认结果所依据的临床信息,包括检查类型及结果;2.各类检查的设备信息,包括影像检查的扫描条件等;3.已确认结果所依据的临床准则;4.得出已确认结果的医师情况,包括专家会诊,需明确医师资质;5.若还依据了随访数据,则还需明确随访的时间以及随访所做的检查类型及结果。
金标准独立于待研究的诊断方法可以减少偏倚,一是提供给专家组的待评阅数据需不包含AI标记结果;二是对于样本量非常大或影像评阅耗时长的研究,也可将包含和不包含AI辅助标记的结果同时提供给专家组,但两组结果是否采用AI辅助需对专家组设盲,由专家组自行开展综合评阅。
(六)样本量估算
样本量估算需综合考虑临床试验设计、主要评价指标和统计学要求。申请人需明确计算公式、相应参数及确定理由,以及所用的统计软件。
鉴于采用高于临床总体的样本患病率可以降低研究所需的样本量,节约时间和试验花费,且临床上对于一定样本量下的研究中,患病率是否影响灵敏度、特异度等固有诊断准确性指标尚无统一定论,且多数研究倾向于影响较小,增大受试人群阳性比例可能是合理的(例如可考虑采用阳性样本与阴性样本1:1的比例设定)。临床试验资料中可以提供样本患病率以及目标疾病的流行病学研究的患病率情况进行合理性论述,并确保临床研究设计中样本数据随机分配给阅片者进行评阅。
平行对照试验样本量计算可参考《医疗器械临床试验设计指导原则》中的相关内容。
若采用MRMC的试验设计,样本量计算需首先明确具体的分析方法,如Obuchowski-Rockette Analysis(OR分析方法)、Dorfman-Berbaum-Metz-Hillis Analysis(DBMH分析法),并进一步明确受试医师数量,显著性α、把握度1-β、预计效应值,优效/非劣效界值,其中预计效应值可通过预试验或调研并汇总分析目标病灶检出的诊断学研究文献获得。以DBMH分析法为例,样本量估算与交互随机效应值,检验的把握度、显著性,受试医师数量,优效界值,非劣效界值(如有)等要素有关。用于样本量估算的效应值(effect size)选择时,可通过预试验得到的误差和混合效应方差来估计,并考虑预试验样本量等情况,在预试验结果的基础上采用适度保守的估计。
所有应用了试验产品的受试医师和患者都将被纳入分析,对于主要指标,除给出主要评价指标(灵敏度、特异度、AUC)的点估计外,还将分别对其对应的95%置信区间进行估计,通过试验组与对照组的优效/非劣效比较判断本试验产品是否满足临床应用的需要。
(七)其他临床试验设计需关注的问题
1.临床试验培训
在试验前对阅片者开展必要的培训,可以有效降低试验的偏倚。除基本情况培训(试验流程、术语定义、数据样本阅片的评价标准等)以外,还需考虑案例培训和典型数据样本讲解等,且所用案例独立于试验研究数据样本;培训中宜设置阅片者培训结果测试及合格接受标准;建议临床试验中,对阅片者的培训与临床应用时的培训,在方法、时间、接受标准上尽量保持一致性;并考虑对临床试验阅片者资质、能力等要求与临床应用时使用者情况的匹配性。对专家组的培训时间和接受标准宜显著高于试验组。
2.影像样本评阅质量控制
一是由阅片者在独立盲法条件下对患者关于试验的影像检测结果进行解释。二是在选取试验阅片者时基于其专业能力和参与研究的可能性,充分保证阅片者对预期使用者的代表性。可考虑不同机构来源、不同年资/专业水平的医师。三是试验组与对照组使用相同软件界面,对照组医师软件界面无法开启人工智能辅助决策功能。四是将数据样本的临床诊断结果、金标准判定结果、其他诊断信息(如生化检测结果、后续治疗等)或基本信息(如年龄、病史等)对试验的阅片者隐藏。五是对照试验可考虑采用交叉阅片设计,交叉设计中可根据相关领域记忆曲线的研究设置合理的洗脱期。若采用多阅片者,最好每位阅片者按照不同的数据样本顺序进行评阅,有文献报道典型的洗脱期一般为4~6周。是否采用交叉设计可根据申报产品的临床应用方法、场景及适用范围等综合判定。
三、产品中非辅助决策临床功能的评价
深度学习辅助决策医疗器械产品还可能包括结构化报告生成、前后片对比、正常组织的分割(如肺叶、肋骨等)、尺寸测量、CT值计算等非辅助决策类软件功能,这些功能可在临床试验中设置次要评价指标一并评价其安全有效,亦可根据《医疗器械临床评价技术指导原则》提交相应临床评价资料。若提交临床评价,上述功能的验证确认可以考虑测试集测试、压力测试、对抗测试、质量良好的数据库测试结果中的一种或几种作为临床评价的支持证据;若在临床试验中设置次要指标,指标一般采用临床上对功能准确性评价的金标准或学术上常用的方法,如分割的准确性考虑,与医师的分割结果的分割一致性Dice相似系数(Dice similarity coefficient)等;配准功能可考虑标志点配准误差(Fiducial Registration Error)、目标配准误差(target registration error)、标志点定位误差(Fiducial Localization Error)等。
四、与临床评价相关的说明书内容
说明书中一般需结合临床与非临床资料给出下列适用的信息:1)临床试验总结;2)适用范围;3)数据采集设备和数据采集过程相关要求等。临床评价总结通常考虑临床数据基本信息、评价指标与结果(必要时含亚组结果)。人工智能辅助检测类产品的适用范围需明确辅助检测适应症(如肺结节、骨折),所基于的影像类型(如胸部CT或结肠镜检查影像),产品其他主要功能(如影像的显示、处理、测量和分析),以及产品临床定位(不能单独用作临床诊疗决策依据)等。
建议申请人根据产品实际情况在说明中体现如下方面的警告注意事项。1)软件仅辅助医师进行检测,存在假阴/阳性可能,应由专业医师结合患者的病史、症状、体征、其他检查结果情况综合给出最终的病灶检出结论,核实是否需要进行一步诊疗的决策,并对临床诊断结果负责。2) 产品依据XXX版指南(例如《胸部CT肺结节数据标注与质量控制专家共识(2018)》)设计,如诊疗指南有所更新,使用者应充分评估指南差异可能带来的风险。3)明确产品临床试验中未对病灶边界分割的准确性进行评价,如依据软件的检测结果决定手术干预或穿刺活检,医师应当充分评估其风险。
附录1 肺结节人工智能辅助检测产品临床评价考虑要素举例
一、试验设计基本类型
肺结节CT影像辅助检测产品采用MRMC设计、交叉自身对照设计或平行对照设计。平行对照设计的具体过程及方法参考《医疗器械临床试验设计指导原则》相关内容。
若采用MRMC的设计,试验过程具体为,将参与试验的临床医师随机划分为A、B两组。A组:医师第一阶段在使用AI辅助的条件下完成所有数据样本CT影像的肺结节检测;经一定的洗脱期后,第二阶段在不使用AI辅助的条件下完成所有数据样本CT影像的肺结节检测。B组:医师第一阶段在不使用AI辅助的条件下完成所有数据样本CT影像的肺结节检测;经一定的洗脱期后,第二阶段在使用AI辅助的条件下完成所有数据样本CT影像的肺结节检测。该试验中医师使用AI辅助的作为试验组,不使用AI辅助的作为对照组,对比试验组与对照组肺结节检测的诊断准确度指标,阅片过程中每名医师需分别在使用AI和不使用AI的条件下都完成所有入组影像数据样本的阅片。
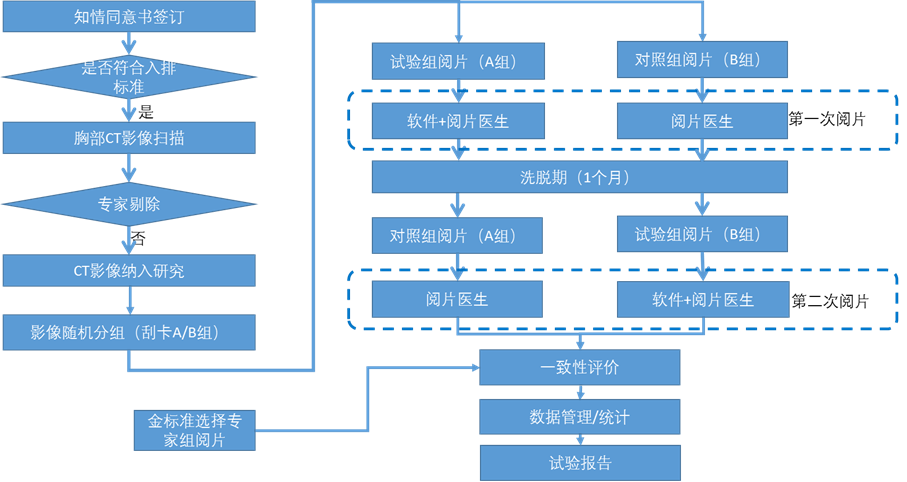
二、评价指标
此类产品临床试验通常选择检出的灵敏度(以病灶为单位)和特异度(以患者为单位)等组成的复合指标,亦可在此基础上添加受试者工作特征(receiver operating Characteristic, ROC)曲线或其衍生曲线组成复合指标,如因变量自由的受试者工作特征(free-response receiver operating Characteristic, FROC)曲线、定位受试者工作特征(location-specific receiver operating characteristic, LROC)曲线等。使用ROC曲线或其衍生曲线时,可考虑在试验组医师阅片阶段,由阅片医师标记对目标疾病判定的把握度(可考虑百分数评分),从而构建ROC曲线,并需考虑在培训阶段明确医师百分数评分的标准和方法。
次要指标可包括AI辅助医师检出目标疾病的阳性预测值/阴性预测值,似然比,Kappa系数,软件独立检出目标疾病的灵敏度(以病灶为单位),软件独立检出目标疾病的灵敏度和特异度(以患者为单位),阅片时间,医生诊断信心评价,软件功能易用性和稳定性(可采用主观感受评价,如李克特量表等)。若同时观察量化分析等非辅助决策临床功能的性能表现,亦可设立相应次要评价指标。
三、样本量估算及统计学分析
以MRMC设计为例,说明样本量估算考虑要素,若主要评价指标为AUC、结节水平灵敏度、患者水平特异度。试验中,检验的把握度取80%。对于主要评价指标,优效性与非劣效统计分析将在单侧0.025的显著性水平下进行。
1.基于AUC的样本量计算,预试验或文献资料确认效应值取0.05,受试医师设定为12名,AUC优效界值取0,则总样本量不得低于87例,阴性、阳性患者比为1:1。
2.基于结节水平灵敏度,效应这去0.069,受试医师设定为12名,优效界值取0,需阳性样本至少116个结节,假定平均每个阳性患者存在2个结节,则至少需要58例阳性数据样本。
3.基于患者水平的特异度,效应值取-0.055,非劣效值取0.1(参考Riverain ClearRead CT 的特异度95%区间下限),在当受试医师为12名时,非劣效验证(非劣效界值取0.1)需要阴性样本达到至少157例。
综合以上各指标样本量估算值,本试验样本量最低为215例,阳性数据样本58例,阴性数据样本157例。考虑到样本存在剔除和脱落的可能,当预期脱落率为5%,剔除率为5%时,阳性样本需要达到至少62例,阴性样本需要达到至少166例,共计228例。
附录2. 结肠息肉人工智能辅助检测产品临床评价考虑要素举例
一、试验设计基本类型
基于结肠镜等实时影像结果的辅助检测可考虑平行对照设计,具体设计及试验程序(以序贯的平行对照为例)如下:
入组的受试者随机分配到A组和B组, A组:常规结直肠镜检查先进行组:先接受无 AI 辅助的常规结直肠镜检查,对检查过程中发现的所有息肉都冻结影像留存图片。第一次退镜后在AI 辅助下再做一次结直肠镜检查,对检查过程中发现的所有息肉都冻结影像留存图片。B 组:AI 辅助检查先进行组:先接受 AI 辅助的结直肠镜检查,对检查过程中发现的所有息肉都冻结影像留存图片。第一次退镜后再进行一次常规结直肠镜检查,对检查过程中发现的所有息肉都冻结影像留存图片。分别以各组两次检出的肠息肉作为基准,比较第一次检查时,有AI辅助检测和无AI辅助检测的病变检出能力。
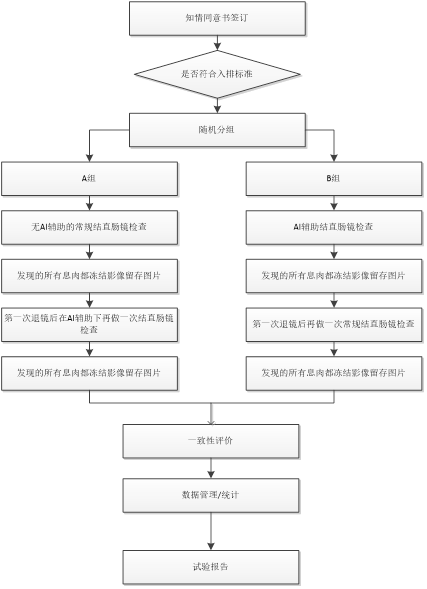
二、评价指标
此类产品临床试验因不完美金标准等问题,可考虑选取息肉/腺瘤的初检检出率/漏诊率或息肉检出的敏感性与特异性等作为主要评价指标。相关指标需以息肉/腺瘤水平而非受试者水平进行计算,例如初检息肉检出率=初检发现的息肉数量÷两次检测到的息肉总数,腺瘤漏诊率=第二次检测到的腺瘤数÷两次检测到的腺瘤总数。
次要评价指标可考虑息肉/腺瘤检出率(受试者水平),平均息肉/腺瘤检出数,软件独立评估性能(即软件独立的息肉/腺瘤检出率、息肉检测准确性等):结直肠镜操作时间(包括各次进镜时间、退镜时间)、软件易用性评价、稳定性评价、不良事件情况等。若同时观察图像传输、储存等非辅助决策临床功能的性能表现,亦可设立相应次要评价指标。
三、样本量估算
1.以序贯的平行对照试验为例,若采用腺瘤漏诊率作为评价指标,样本量的计算基于腺瘤漏检率的主要结果(每个病灶),假设如下: AI 先进行组别的腺瘤漏诊率为 10%,标准检查先进行组别的腺瘤漏诊率为 30%,优效界值设定为0,在 80%统计功效的条件下, 双侧α值设为 0.05。主要评价指标为初检息肉检出率,其样本量估算公式为:
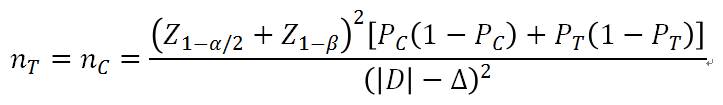
假设每位患者的平均腺瘤数为 0.6,考虑10%的脱落率,需入组220名受试者,AI 先进行组110名,标准检查先进行组110名。
2.若采用初检息肉检出率作为主要评价指标,A 组: 常规结直肠镜检查先进行组; B 组: AI 辅助检查先进行组。PC、 PT 分别为 A 组和 B 组预期初检息肉检出率,其中 PC=70%、 PT=80%;|D|为两组预期率差的绝对值, |D| = |PC - PT|; Δ 为优效性界值,取0。主要评价指标为初检息肉检出率,其样本量估算公式为:

假设每位患者的平均息肉数为2.5,需约234例,脱落率为20%,最终样本量为296例,A组和B组各148例。
五、参考文献
[1] 中华医学会呼吸病学分会肺癌学组, 中国肺癌防治联盟专家组,肺结节诊治中国专家共识(2018版)[J]. 中华结核和呼吸杂志, 2018,41(10): 763-771.
[2] 国家药品监督管理局医疗器械技术审评中心. 总局关于发布医疗器械临床试验设计指导原则的通告[EB/OL].(2018-01-04) [2021-05-01]. https://www.cmde.org.cn/CL0058/6882.html
[3]国家药品监督管理局医疗器械技术审评中心.关于发布深度学习辅助决策医疗器械软件审评要点的通告[EB/OL]. (2019-07-03)[2021-02-04]. https://www.cmde.org.cn/CL0050/19360.html
[4] Guidance for Industry and Food and Drug Administration Staff Computer-Assisted Detection Devices Applied to Radiology Images and Radiology Device Data - Premarket Notification [510(k)] Submissions(FDA,2012.07.03)
[5] Lung Cancer Screening CT ProtocolsVersion5.1(AAPM,2019.9.13)
[6] FDA. Clinical Performance Assessment: Considerations for Computer-Assisted Detection Devices Applied to Radiology Images and Radiology Device Data - Premarket Approval (PMA) and Premarket Notification [510(k)] Submissions - Guidance for Industry and FDA Staff,(2012.11)[2021-4-15]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/clinical-performance-assessment-considerations-computer-assisted-detection-devices-applied-radiology
[6] Sica, G.T., 2006. Bias in research studies. Radiology, 238(3), pp.780-789.
[7] Xiao-Hua Zhou, Nacy A. Obuchowski, Donna K. McClish. Statistical Methods in Diagnostic Medicine [M]. Hoboken: JohnWiley&Sons, 2011.
[8] 国家卫生健康委员会. 《人工智能辅助诊断技术临床应用质量控制指标(2017年版)》.国家卫生计生委办公厅关于印发造血干细胞移植技术管理规范(2017年版)等15个“限制临床应用”医疗技术管理规范和质量控制指标的通知[EB/OL].(2017-02-17)[2021-4-27] http://www.nhc.gov.cn/yzygj/s3585/201702/e1b8e0c9b7c841d49c1895ecd475d957.shtml
[9] Brandon D. Gallas.et al. Evaluating Imaging and Computer-aided Detection and Diagnosis Devices at the FDA [J]. Acad Radiol. 2012 Apr; 19(4): 463–477. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5557046/
[10] 萧毅, 刘士远. 肺结节影像人工智能技术现状与思考[J]. 肿瘤影像学, 2018, 27: 249-252.
[11] Rees, Colin J., et al. “UK key performance indicators and quality assurance standards for colonoscopy.” Gut 65.12 (2016): 1923-1929.
[12] Misawa, Masashi, et al. "Development of a computer-aided detection system for colonoscopy and a publicly accessible large colonoscopy video database (with video)." Gastrointestinal endoscopy 93.4 (2021): 960-967.
[13] 国家消化系统疾病临床医学研究中心(上海), 中华医学会消化内镜学分会, 中华医学会健康管理学分会等. 中国早期结直肠癌筛查流程专家共识意见(2019). 中华医学会杂志,2019,99(38):2961-2970.
[14] Rompianesi, Gianluca, et al. "Artificial intelligence in the diagnosis and management of colorectal cancer liver metastases." World Journal of Gastroenterology 28.1 (2022): 108.
一次性使用血液透析器临床评价注册审查指导原则(征求意见稿)
本指导原则旨在指导注册申请人对一次性使用血液透析器注册开展临床评价,同时也为技术审评部门审评一次性使用血液透析器临床评价资料提供参考。
本指导原则是对一次性使用血液透析器临床评价的一般要求,注册申请人需依据产品的具体特性确定其中内容是否合适。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对注册申请人和技术审评人员的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,需在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于一次性使用血液透析器,包括低通量透析器和高通量透析器,在医疗机构用于急、慢性成人肾功能衰竭患者,进行常规的血液透析治疗。该产品分类编码为10-04-01,管理类别为三类。
二、临床试验基本要求
一次性使用血液透析器通常需通过临床试验路径进行临床评价,当注册申请人通过临床试验开展血液透析器的临床评价时,可参考本章要求开展临床试验。如注册申请人选择同品种路径进行临床评价,需满足本指导原则第三部分的相关要求,按照本导则第三部分内容提供相应资料。
(一)临床试验目的
临床试验需设定明确、具体的试验目的。申请人可综合分析试验器械特征、非临床研究情况、已在中国境内上市(下文简称已上市)同类产品的临床数据等因素,设定临床试验目的。临床试验目的决定了临床试验各设计要素,包括主要评价指标、试验设计类型、对照试验的比较类型等,进而影响临床试验样本量。
(二)临床试验设计类型
建议开展多中心临床试验,临床试验类型为前瞻性、随机对照。对照组一般选择透析参数和膜材料相似的透析器。
(三)入排标准
试验对象需具有代表性,对入选标准和排除标准需有详细说明。试验对象原则上需为开展维持期血液透析的慢性肾衰竭成年患者,标明年龄、性别、原发病、特殊要求等。排除标准通常包括试验对象伴有严重贫血,感染,肿瘤,活动出血,严重心、肝、肺脏疾病,精神异常或病情不稳定等患者等,或有其他不适合试验的情况,如产品有风险、对患者有伤害或影响疗效。
(四)评价指标
1.主要评价指标
低通量血液透析器主要评价指标包括肌酐清除率与尿素氮清除率,对于高通量血液透析器还包括β2微球蛋白(β2-MG)下降率。若注册申请人通过增大纤维膜的标称孔径等宣称扩大物质清除范围,除以上主要评价指标外,还需根据产品自身特点增加合适的主要评价指标并论述其选择的合理性,如考虑以λ游离轻链为代表的中分子物质的清除率作为主要评价指标之一。此时,需同时评价患者体内白蛋白的丢失情况,以白蛋白下降为主要评价指标,明确随访时间以及确定依据。
透析溶质清除率需平稳透析60min后,在固定工作状态下的血流量和透析液流量(通常设置超滤率0或者10mL/min),同时从透析器动静脉端抽血,检测肌酐、尿素氮、β2-MG或λ游离轻链等并计算清除率。通常按照如下公式进行计算:
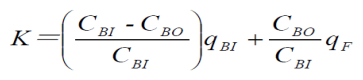
CBI和CBO采用的浓度单位相同;CBI是指血液透析器血液入口的溶液浓度;CBO是指血液透析器血液出口的溶液浓度;qBI是指产品入口端的血液流速;qF是指滤过液流速(超滤率)。
2.次要评价指标
2.1肌酐下降率、尿素氮下降率、以及适用时的代表性中分子物质的下降率。测定透析溶质下降率时,在透析开始和结束时抽血,停止超滤,血流量先减至100mL/min后,停泵立刻从患者体内抽血,透析溶质下降率=1-(透析后血浓度/透析前血浓度)%。
注:测定下降率时,在透析开始和结束时抽血,停止超滤,血流量先减至100mL/min后,停泵立刻从患者体内抽血。
2.2超滤率及超滤系数:超滤率(mL/h)=总除水量(mL)/治疗时间(h)。
2.3 C反应蛋白、透析开始时和透析15min后血气、透析开始后15min白细胞及血小板下降率等。
2.4血常规、肝肾功能、血电解质(包括血钾、血钙、血磷、HCO3-或CO2CP等)、白蛋白、球蛋白、C-反应蛋白。生命体征:血压、脉搏、体温、心率;患者一般状态:患者自我感觉、首次使用综合症及体征变化;与使用透析器相关的数据变化;与透析器功能相关的实验室参数。
2.5安全性指标:不良事件发生情况及严重不良事件发生情况,明确事件的具体信息如患者信息、发生时间、原因、后果、处理措施、患者转归及与器械的相关性等。
(五)并发症及处理预案(预计本试验中可能出现的并发症及如何处理)
包括透析中低血压、肌肉痉挛、恶心和呕吐、头痛、胸痛和背痛、皮肤瘙痒、失衡综合征、透析器反应(临床分为A型和B型反应)、心律失常、溶血、空气栓塞、发热、透析器破膜、体外循环凝血等。
(六)临床试验样本量
根据对照用血液透析器的相应指标的循证医学相关资料做出检验假设并计算样本量。同时,样本量的确定与选择的假设检验类型(优效、非劣效、等效性检验)及I、II类错误和具有临床意义的界值(疗效差)有关,同时还需考虑预计排除及临床失访的病例数。
临床试验样本量的确定需符合临床试验的目的和统计学要求,并且完成所有访视的受试者不应少于临床试验方案中规定的最低样本量。为保证各主要评价指标的检验功效均不低于80%,临床试验选择计算例数最多的主要评价指标的样本含量为临床试验样本量。临床试验如为非劣效设计,非劣效界值不大于主要评价指标平均水平的10%。若申报产品包含不同膜面积产品,建议注册申请人在1.5m2以及1.5m2-2.0m2区间内分别选择代表性产品进行样本量估计并开展临床试验。
三、同品种临床评价基本要求
以下两种情形下,血液透析器可通过同品种路径开展临床评价,一是申报产品使用的透析膜已在中国境内获准上市,注册申请人可选择具有相同透析膜的透析器作为同品种医疗器械;或二是申报产品的前代产品已在中国境内获准上市,申报产品是对前代产品透析膜壁厚及纹理/波形进行改变,注册申请人可选择前代产品作为同品种医疗器械。此时,血液透析器同品种临床评价相关要求如下:
(一)适用范围及临床使用相关信息的对比
申报产品与同品种医疗器械需有相同的适用范围,需比对的信息包括适用范围、适应证、适用人群及使用时间等。
(二)技术特征的对比
1. 结构组成
注册申请人需对比申报产品与同品种医疗器械的结构组成,关注透析膜材料和设计特征的对比,其包括但不限于透析膜材料、透析膜面积大小、纤维数量、有效纤维长度、纤维内径、纤维壁厚、纤维膜标称孔径大小及分布范围、孔隙率等。
2.性能指标
申报产品与同品种医疗器械需在同等的检测条件下进行性能检测,若申报产品包括不同膜面积,按照膜面积<1.5m2,1.5m2-2.0m2分别进行性能测试。透析器性能参数的比对建议重点考虑以下内容(包括但不限于):
2.1.清除率:常用尿素、肌酐、磷酸盐、维生素B12的清除率评价透析器的滤除性能,对于高通量透析器,还需比对申报产品与同品种产品β2-MG的清除率。若注册申请人通过增大纤维膜的标称孔径等扩大物质清除范围,还需根据产品自身特点增加合适物质的清除率并论述其其选择的合理性,如考虑以λ游离轻链为代表的中分子物质的清除率。
测定清除率需覆盖注册申请人申报的血液流速和透析液流速范围。相关物质的清除率测定可选择透析液流速的最低和最高点,并分别对应注册申请人申报的血液流速的最低流速、每增加100mL/min的血液流速,直至最高血液流速。
2.2.超滤率与超滤系数:超滤率可评价血液透析器对水的清除能力。测定超滤率需覆盖注册申请人申请的跨膜压(TMP)和血液流速的范围。将测定的多个超滤率及其对应的TMP进行线性回归,以计算超滤系数。如高通量透析器,可在600-1800mL/h超滤率范围内,测定至少4个数据点的超滤率并记录该超滤率下的TMP,通过超滤率与TMP的斜率来计算其超滤系数。
2.3.压力降:测定压力降需覆盖注册申请人申请的血液流速及透析液流速范围。建议在血液流速为100mL/min、200mL/min、300mL/min、400mL/min时测量血液侧的压力降;在透析液流速为500mL/min、600mL/min、700mL/min、800 mL/min时测量透析液侧的压力降。当最高血液流速和最高透析液流速与上述建议值不同时,还需分别测量最高血液流速和最高透析液流速下的压力降。
2.4. 筛选系数:高通量透析器还需测定筛选系数。建议在血液流速为 200mL/min、300mL/min、400mL/min、500mL/min以及最大流速(当与上述流速不同时)时测量白蛋白、菊粉、肌红蛋白或β2-MG的筛选系数。
(三)差异性部分的安全有效性证据
1. 申报产品为新注册产品,其使用的透析膜已在境内获准上市,注册申请人选择具有相同透析膜的透析器作为同品种医疗器械时,注册申请人需按照上述要求进行结构组成、透析膜材料和设计特征以及相关性能指标的对比,在充分识别申报产品与同品种医疗器械相同性和差异性的基础上,论证二者的等同性。如申报产品的设计影响血液流动模式,或是最大血液流速与同品种医疗器械存在明显差异,申请人需提供最大血液流速下机械性溶血测试数据,以验证该设计不会引起红细胞的过度溶解。建议在最大血液流速下进行测试。
2. 申报产品的前代产品已在中国境内获准上市,申报产品是对前代产品透析膜的壁厚及纹理/波形进行改变,注册申请人选择前代产品作为同品种医疗器械,在结构组成、透析膜材料和设计特征以及相关性能指标对比的基础上,还需针对差异部分开展临床试验,以确认血液透析器的临床性能。
2.1总体要求:通过12名受试者接受总计36次治疗的数据,验证血液透析器的临床性能。如申报产品包括不同膜面积,建议在膜面积<1.5m2以及1.5m2-2.0m2范围内各自选择代表性产品,分别开展临床试验,
2.2评价指标
2.1.1超滤率和超滤系数:每名受试者测定4个数据点的超滤率,通过线性回归计算超滤率与其对应的TMP的斜率,获得体内超滤系数。例如对于高通量透析器,在预先设定的时间点,超滤率分别为600mL/h、1000mL/h、1400mL/h、1800mL/h,5分钟之后记录实际TMP。通过12例受试者的超滤系数,反映透析器体内的超滤系数,以体内外外超滤系数的百分比评价体内外超滤系数的一致性。
2.2.2尿素氮、肌酐、磷酸盐清除率、β2-MG下降率(高通量透析器)。
2.2.3透析开始后15min白细胞、血小板下降率,透析开始时和开始后15min的血气分析,透析前后的红细胞、白细胞、血小板变化情况。
2.2.4不良事件的发生情况、处理方式及处理结果,包括补体激活和血栓形成等。
2.3数据分析及结论
注册申请人需对临床试验结果进行分析,评价产品的临床性能。
(四)同品种产品的临床数据
建议参考《医疗器械临床评价技术指导原则》要求,提交同品种产品的临床数据;临床试验或临床使用获得的数据(以下简称临床数据)可来自中国境内和/或境外公开发表的科学文献和合法获得的相应数据,包括临床试验数据、临床经验数据、临床文献数据等。临床文献数据的收集应保证查准、查全,具有可重复性;临床经验数据收集应包括对已完成的临床研究、不良事件、与临床风险相关的纠正措施等数据的收集。注册申请人可依据产品的具体情形选择合适的数据来源和收集方法。
同品种医疗器械临床数据需在国内现行血液透析操作规范的条件下(特别是血液流速与治疗次数)收集。
四、参考文献
[1]《医疗器械临床评价技术指导原则》(2021年第73号通告)[Z].
[2]《决策是否开展医疗器械临床试验技术指导原则》(2021年第73号通告)[Z].
[3]《医疗器械临床试验设计指导原则》(2018年第6号通告)[Z].[4]《医疗器械临床评价等同性论证技术指导原则》(2021年第73号通告)[Z].[5]《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号通告)[Z].
[4]《一次性使用透析器产品注册技术审查指导原则》(2013年第3号通告)[Z].
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习。
热门推荐
最新推荐

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。







