2022年度广东省医疗器械注册工作报告
药监头条 广东省
2022年,广东省药品监督管理局(以下简称:省药监局)始终坚持以习近平新时代中国特色社会主义思想为指导,深入学习贯彻党的二十大精神,认真落实党中央、国务院和省委省政府决策部署,深入贯彻《广东省推动医疗器械产业高质量发展实施方案》,坚持“强监管守底线保安全、优服务追高线促发展”,深化审评审批制度改革,持续推进监管创新,强化医疗器械注册管理,助推产业创新高质量发展。
一、广东省注册工作亮点与成效
(一)高效推进疫情防控产品优先审批
2022年,按照国家药品监督管理局、省联防联控机制工作部署,省药监局积极开展疫情防控产品的应急和优先审批有关工作,主动帮扶抗原试剂、ECMO生产企业扩大生产产能。全省共有7个新冠病毒抗原试剂获批上市,3个产品获准紧急使用,完成25个新冠病毒检测试剂注册申报资料的初审;2家企业的ECMO产品纳入应急审批程序,其中深圳汉诺公司取得首个国产体外膜肺氧合治疗(ECMO)产品注册证。对血氧仪、制氧机、防护口罩等紧缺产品快审快批,共批准22个产品上市,全省获批注册的新冠病毒检测试剂、呼吸机、医用口罩、红外体温计数量位列全国第一。
(二)促进产业创新高质量发展成果丰硕
2022年,省药监局持续推进创新、优先医疗器械加快上市,加速高端医疗装备国产化进程,推动膝关节置换手术导航定位系统、集成膜式氧合器、血管内超声诊断仪器等8个三类创新医疗器械获批上市,2个产品进入国家药品监督管理局优先审批程序,向国家药品监督管理局推荐52个申报创新认定产品。全省累计63个产品进入创新医疗器械特别通道,已有25家企业的31个第三类创新医疗器械获批,数量居全国第三位。
按照《广东省药品监督管理局生物医药产业重点项目、重点企业、重点地区创新服务管理办法》,省药监局共发布4批“三重”创新服务名单,共计11个创新医疗器械纳入重点项目名单,其中7个项目已经完成注册审批。
2022年,为进一步激发产业发展活力,更好支撑医疗器械产业高质量发展,省药监局配合省工信厅开展生物医用材料创新任务揭榜挂帅工作。在工信部、国家药品监督管理局公布的人工智能医疗器械创新任务揭榜入围单位名单中,我省有20个单位共21个项目入选。
(三)持续推进大湾区医疗器械监管创新
2022年,港澳医疗器械注册人在粤港澳大湾区内地9市生产医疗器械实施方案获得国家药品监督管理局批准。为进一步释放政策红利,优化审批工作流程,省药监局发布了粤港澳大湾区内地临床急需进口港澳药品医疗器械预审品种数据库。对已纳入目录的临床急需医疗器械,再次申请时,审批时限缩短至15个工作日。5家单位纳入“港澳药械通”第一批指定医疗机构,累计发布3批粤港澳大湾区内地临床急需进口港澳药品医疗器械目录,累计批准13个医疗器械进口使用。其中磁力可控延长钛棒以实物模型,作为“奋进新时代”主题成就展广东区展品在京展出。
(四)优化第二类医疗器械审评审批现成效
2022年,省药监局印发《关于优化第二类医疗器械注册审评审批的若干措施》,提出优化审评服务,健全分路径审评机制,优化现场检查流程,统一技术审评标准,细化配套措施等二十条举措,配套出台《关于已上市第二类医疗器械迁入我省注册申报指引(试行)》《第二类医疗器械(体外诊断试剂)注册证核发事项受理审查要求》《关于实施医疗器械主文档登记事项的通告》《关于医疗器械检验的工作指引》《优检十二条》等制度,全面加快我省第二类医疗器械上市审批进程。自2022年6月开展优化措施以来,共办结第二类医疗器械注册业务2625宗,技术审评平均用时46个工作日(含补后审查),比法定时限压缩近61%;注册检验平均用时48个工作日,同比提速38%;行政审批合计平均用时2个工作日,比法定时限压缩近90%。
(五)医疗器械注册管理工作进一步加强
医疗器械唯一标识工作深入推进。2022年,省药监局联合省卫生健康委、省医保局持续推进唯一标识工作,推荐中山大学附属第一医院等3家单位入选国家药品监督管理局首批医疗器械唯一标识实施示范单位名单,遴选并公布18家省级示范点名单。加强唯一标识的推广应用,组织开展广东省医疗机构医疗器械唯一标识(UDI)应用评价体系研究,全省已有769家企业开展唯一标识数据上传与维护。
新版GB 9706系列标准实施平稳有序。省药监局成立工作专班,明确成员职责,印发工作方案。共组织开展12期标准宣贯培训,全省共有1538家企事业单位参加了新版标准相关培训学习。开展医疗器械检验能力提升行动,省内已取得新版GB9706.1-2020标准检验资质的检验机构有12家,占全国总数的19%,全年省内各检验机构累计收检1463个产品。
医疗器械临床试验监管进一步加强。2022年,省药监局组织开展医疗器械临床试验机构备案后监督检查35家,实现全省医疗器械临床试验机构备案后监督检查100%全覆盖。在全国率先启用医疗器械临床试验严重不良事件电子化上报告功能。依托省药品检查中心,加强临床试验检查员队伍建设。充分发挥省级医疗器械临床试验专委会作用,持续强化行业自律。
医疗器械注册信息化水平不断提升。在全国率先实施医疗器械注册全程无纸化,全流程审评审批进度实时公开,全面发放医疗器械电子注册证,实现二类注册证信息与国家药品监督管理局注册数据库实时对接。2022年,省药监局对电子申报系统进一步升级改造,上线运行注册申报与检验报告对接、补充资料预审服务、注册证书内容确认、智能制证等功能模块,便利申请人办事。
医疗器械注册管理能力进一步提升。2022年,省药监局组织开展5个注册质量管理体系核查工作标准和规程制修订,完成7个国家药品监督管理局下达的注册审查指导原则编写工作;推动制定一次性使用采样拭子、样本保存管(含保存液)、全自动核酸提取仪、医用退热贴等一批团体标准;配合国家药监局开展医疗器械注册审评实训基地建设,承担2期实训任务;组织开展第二类医疗器械注册清理规范,对9692个已注册产品全面排查;完善分类界定管理,优化办理流程,持续提高分类界定申请告知率;加强分类技术支撑能力建设,全省21名专家入选第二届国家医疗器械分类技术委员会委员;开展2期第一类医疗器械备案质量评估,督促市局对已备案产品信息进行回顾性审查,强化属地监管责任,强化企业主体责任。
二、广东省第二类医疗器械注册申请受理情况
(一)整体情况
2022年,省药监局共受理第二类医疗器械首次注册、延续注册和变更注册申请共计6390项,与2021年相比减少11.20%。
按注册品种区分,医疗器械注册申请4242项,体外诊断试剂注册申请2148项。
按注册形式区分,首次注册申请2102项,占全部第二类医疗器械注册申请的32.9%;延续注册申请1137项,占全部第二类医疗器械注册申请的17.8%;许可事项变更注册申请957项,占全部第二类医疗器械注册申请的15.0%;登记事项变更注册申请2194项,占全部第二类医疗器械注册申请的34.3%(受理情况及注册形式分布比例分别见图1、图2)。
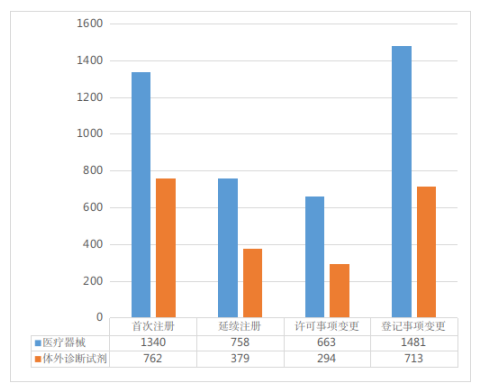
图1 注册申请受理情况
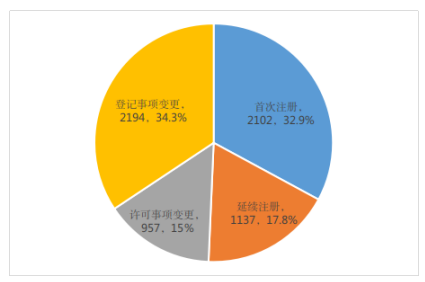
图2 注册申请受理按注册形式分布比例图
(二)注册受理按地域分布情况
2022年,广东省各地市第二类医疗器械注册申请受理总量情况见表1。
表1 2022年广东省各地市第二类医疗器械注册申请受理总量情况(单位:项)
地区 | 深圳 | 广州 | 珠海 | 佛山 | 东莞 | 中山 | 惠州 | 江门 | 汕头 | 清远 |
数量 | 3152 | 1561 | 490 | 394 | 267 | 200 | 59 | 54 | 51 | 27 |
地区 | 湛江 | 揭阳 | 茂名 | 梅州 | 潮州 | 肇庆 | 韶关 | 河源 | 阳江 | 汕尾 |
数量 | 23 | 19 | 18 | 16 | 14 | 12 | 10 | 8 | 8 | 7 |
(三)首次注册受理按地域分布情况
2022年,各地市第二类医疗器械首次注册申请受理情况见表2。
表2 2022年广东省各地市第二类医疗器械首次注册申请受理情况(单位:项)
地区 | 深圳 | 广州 | 佛山 | 珠海 | 东莞 | 中山 | 江门 | 惠州 | 汕头 |
数量 | 1016 | 514 | 167 | 154 | 104 | 67 | 21 | 15 | 10 |
地区 | 揭阳 | 汕尾 | 肇庆 | 河源 | 清远 | 茂名 | 阳江 | 梅州 | 韶关 |
数量 | 7 | 5 | 5 | 4 | 4 | 3 | 3 | 2 | 1 |
三、广东省第二类医疗器械注册审批情况
(一)整体情况
2022年,省药监局共批准第二类医疗器械首次注册、延续注册和变更注册共计7086项,与2021年相比增加了6.56%。
按注册品种区分,医疗器械4468项,体外诊断试剂2618项。
按注册形式区分,首次注册2086项,与2021年相比增加了11.55%;延续注册1616项,与2021年相比减少了3.64%;许可事项变更注册1186项,与2021年相比增加了0.34%;登记事项变更注册2198项,与2021年相比增加了14.42%。近七年广东省批准第二类医疗器械注册情况见图3。
从全国注册情况看,广东、江苏、北京、湖南、浙江、河南、山东、上海、湖北、安徽10省(直辖市)注册的境内第二类医疗器械数量较多,其中广东注册的境内第二类医疗器械数量位居首位,首次注册数量排名第二。境内第二类医疗器械注册情况见图4。
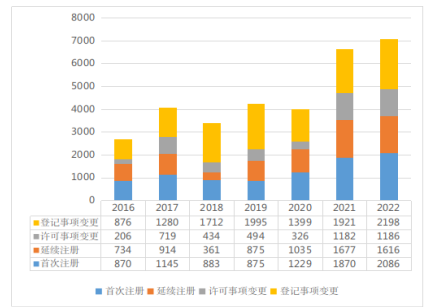
图3 2016至2022年度第二类医疗器械注册数据图
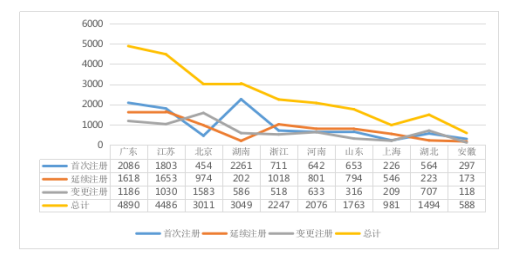
图4 境内第二类医疗器械注册具体数据图
(二)首次注册审批产品分类情况
2022年,省药监局共批准第二类医疗器械(除体外诊断试剂)首次注册共1229项,按国家医疗器械产品分类目录统计,注册证数量排名前五位的产品分类目录分别是:医用诊察和监护器械,注输、护理和防护器械,口腔科器械,医用成像器械,临床检验器械合计818张,占比约66.56%,见图5所示。
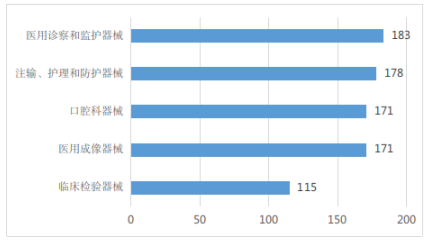
图5 首次注册医疗器械(除体外诊断试剂)数量前五位(按产品分类目录)
(三)首次注册审批产品地区分布情况
2022年,省药监局共批准第二类医疗器械(除体外诊断试剂)首次注册共2086项,各地市的分布情况见表3。
表3 首次注册第二类医疗器械(除体外诊断试剂)地区分布情况(单位:项)
地区 | 深圳 | 广州 | 珠海 | 东莞 | 中山 | 佛山 | 惠州 | 江门 | 汕头 | 河源 |
数量 | 918 | 561 | 145 | 134 | 120 | 118 | 20 | 16 | 13 | 7 |
地区 | 梅州 | 湛江 | 清远 | 韶关 | 茂名 | 阳江 | 揭阳 | 汕尾 | 肇庆 | / |
数量 | 7 | 7 | 6 | 4 | 3 | 3 | 2 | 1 | 1 | / |
四、创新医疗器械注册审批情况
2022年,按照《创新医疗器械特别审查程序》,省药监局继续做好相关产品的审查工作,共收到创新医疗器械特别审批申请10项,其中进入国家药监局创新审批程序的有4项,进入省药监局创新审批程序的有6项,如表4、表5所示。
表4 2022年度进入国家药监局创新审批项目
序号 | 产品名称 | 申请人 |
1 | 全自动外周血细胞形态学分析仪 | 深圳迈瑞生物医疗电子股份有限公司 |
2 | 内窥镜手术器械控制系统 | 深圳市精锋医疗科技有限公司 |
3 | 主动脉弓支架系统 | 先健科技(深圳)有限公司 |
4 | 陡脉冲治疗仪 | 深圳钮迈科技有限公司 |
表5 2022年度进入省药监局创新审批项目
序号 | 产品名称 | 申请人 |
1 | 下肢助行设备 | 深圳市极拓医疗科技有限公司 |
2 | 可溶性白细胞分化抗原14亚型(sCD14-ST)测定试剂盒(化学发光免疫分析法) | 深圳迈瑞生物医疗电子股份有限公司 |
3 | 医用网式雾化器系统 | 深圳摩尔雾化健康医疗科技有限公司 |
4 | 4K双荧光内窥镜摄像系统 | 广东欧谱曼迪科技有限公司 |
5 | 光瞬息视焦矫正系统 | 广州市野光源眼科技有限公司 |
6 | 飞秒无标记扫描显微系统 | 飞秒激光研究中心(广州)有限公司 |
2022年,广东省通过国家药监局批准上市的创新医疗器械有8个,通过省药监局批准上市的创新医疗器械有6个,如表6所示。
表6 2022年度广东省批准上市的创新医疗器械
序号 | 产品名称 | 申请人 | 批准机构 |
1 | 移动式头颈磁共振成像系统 | 佛山瑞加图医疗科技有限公司 | 国家药监局 |
2 | 膝关节置换手术导航定位系统 | 骨圣元化机器人(深圳)有限公司 | 国家药监局 |
3 | 一次性使用血管内超声诊断导管 | 深圳北芯生命科技股份有限公司 | 国家药监局 |
4 | 血管内超声诊断仪器 | 深圳北芯生命科技股份有限公司 | 国家药监局 |
5 | 慢性青光眼样视神经病变眼底图像辅助诊断软件 | 腾讯医疗健康(深圳)有限公司 | 国家药监局 |
6 | 集成膜式氧合器 | 东莞科威医疗器械有限公司 | 国家药监局 |
7 | 血管内超声诊断设备 | 深圳开立生物医疗科技股份有限公司 | 国家药监局 |
8 | 腹腔内窥镜手术系统 | 深圳市精锋医疗科技有限公司 | 国家药监局 |
9 | 微流控芯片分析仪 | 广东国盛医学科技有限公司 | 省药监局 |
10 | 全自动微生物质谱检测系统 | 广州禾信康源医疗科技有限公司 | 省药监局 |
11 | 携带式X射线机 | 深圳市纳诺艾医疗科技有限公司 | 省药监局 |
12 | 全自动血小板抗体检测仪 | 深圳市爱康生物科技有限公司 | 省药监局 |
13 | 一次性电子胃镜 | 惠州市先赞科技有限公司 | 省药监局 |
14 | 医用网式雾化器系统 | 深圳摩尔雾化健康医疗科技有限公司 | 省药监局 |
五、广东省其他注册管理情况
(一)广东省第三类医疗器械注册情况
1、第三类医疗器械注册数量占比情况
根据国家药监局年度医疗器械注册工作报告,2021和2022年度全国各省新增第三类医疗器械注册数量见表7。
表7 2021-2022年度全国各省新增第三类医疗器械注册数量(单位:项)
地区/年份 | 2021 | 2022 | 地区/年份 | 2021 | 2022 | 地区/年份 | 2021 | 2022 |
北京 | 163 | 254 | 安徽 | 5 | 16 | 贵州 | 1 | 0 |
天津 | 55 | 84 | 福建 | 49 | 58 | 云南 | 1 | 3 |
河北 | 14 | 18 | 江西 | 16 | 16 | 重庆 | 8 | 42 |
山西 | 1 | 2 | 山东 | 88 | 122 | 西藏 | 0 | 0 |
内蒙古 | 0 | 1 | 河南 | 0 | 36 | 陕西 | 7 | 20 |
辽宁 | 8 | 11 | 湖北 | 23 | 29 | 甘肃 | 6 | 2 |
吉林 | 11 | 8 | 湖南 | 15 | 33 | 青海 | 0 | 0 |
黑龙江 | 0 | 2 | 广东 | 192 | 319 | 宁夏 | 0 | 0 |
上海 | 116 | 174 | 广西 | 0 | 3 | 新疆 | 0 | 0 |
江苏 | 209 | 395 | 海南 | 28 | 4 | 兵团 | 0 | 0 |
浙江 | 84 | 145 | 四川 | 31 | 47 | / | / | / |
数据来源:国家药监局。
2、第三类医疗器械注册品种分布情况
(1)按区域分布情况
2022年,广东省现存第三类医疗器械注册品种的区域分布情况见表8。
表8 广东省现存第三类医疗器械注册品种区域分布情况(单位:项)
地市/类别 | 有/无源 | 体外诊断试剂 | 总数 |
深圳 | 632 | 325 | 957 |
广州 | 151 | 302 | 453 |
珠海 | 77 | 81 | 158 |
佛山 | 94 | 2 | 96 |
中山 | 17 | 40 | 57 |
东莞 | 50 | 1 | 51 |
江门 | 18 | 0 | 18 |
汕头 | 3 | 12 | 15 |
潮州 | 0 | 11 | 11 |
惠州 | 9 | 0 | 9 |
揭阳 | 6 | 0 | 6 |
湛江 | 5 | 0 | 5 |
梅州 | 1 | 0 | 1 |
总数 | 1063 | 774 | 1837 |
2022年,广东省新增第三类医疗器械注册品种的区域分布情况见表9。
表9 2022年广东省新增第三类医疗器械注册品种的区域分布情况(单位:项)
地市/类别 | 有/无源 | 体外诊断试剂 | 总数 |
深圳 | 144 | 56 | 200 |
广州 | 27 | 27 | 54 |
佛山 | 20 | 0 | 20 |
东莞 | 18 | 0 | 18 |
珠海 | 10 | 6 | 16 |
中山 | 2 | 1 | 3 |
惠州 | 3 | 0 | 3 |
梅州 | 2 | 0 | 2 |
江门 | 1 | 0 | 1 |
潮州 | 0 | 1 | 1 |
揭阳 | 1 | 0 | 1 |
总数 | 228 | 91 | 319 |
(2)按分类目录分布情况
2022年,广东省现存第三类医疗器械(除体外诊断试剂)注册品种按分类目录统计,总数排名前五的情况见表10。
表10 广东省现存第三类医疗器械(除体外诊断试剂)注册品种数量(按分类目录)
序号 | 分类目录 | 批准总量(项) |
1 | 03神经和心血管手术器械 | 194 |
2 | 14注输、护理和防护器械 | 157 |
3 | 06医用成像器械 | 136 |
4 | 13无源植入器械 | 98 |
5 | 10输血、透析和体外循环器械 | 81 |
2022年,广东省新增第三类医疗器械(除体外诊断试剂)注册品种按分类目录统计,总数排名前五的情况见表11。
表11 2022年广东省新增第三类医疗器械
(除体外诊断试剂)注册品种数量(按分类目录)
序号 | 分类目录 | 批准总量(项) |
1 | 03神经和心血管手术器械 | 68 |
2 | 06医用成像器械 | 33 |
3 | 08呼吸、麻醉和急救器械 | 21 |
4 | 14注输、护理和防护器械 | 17 |
5 | 10输血、透析和体外循环器械 | 14 |
(二)注册体系核查情况
2022年,省药监局共完成984笔医疗器械注册体系核查,其中通过核查217笔,整改后通过核查758笔,整改后未通过核查6笔,未通过核查3笔。如表12所示。
表12 2022年广东省医疗器械注册体系核查情况(单位:笔)
完成总量 | 通过 | 整改后通过 | 整改后未通过 | 未通过 |
984 | 217 | 758 | 6 | 3 |
(三)说明书变更情况
2022年,省药监局共完成说明书变更备案480项。2016-2022年度广东省说明书变更基本情况如图6所示。
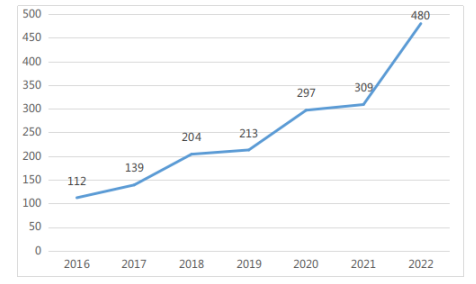
图 6 2016-2022年度广东省说明书变更完成情况(单位:项)
(四)分类界定情况
2022年,省药监局共完成医疗器械分类界定初审1146项。2016-2022年度广东省分类界定基本情况如图7所示。
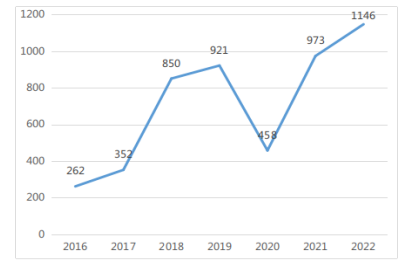
图 7 2016-2022年度广东省分类界定完成情况(单位:项)
(五)医疗器械唯一标识实施基本情况
省药监局发布了第一批广东省医疗器械唯一标识示范单位,包括注册人示范单位3家、经营企业示范单位6家、医疗机构示范单位9家,如表13所示。
表13 广东省医疗器械唯一标识示范单位名单
序号 | 单位名称 | 单位性质 | 备注 |
1 | 深圳迈瑞生物医疗电子股份有限公司 | 注册人 | 国家药监局公布的示范单位 |
2 | 深圳市亚辉龙生物科技股份有限公司 | 注册人 | - |
3 | 广东博迈医疗科技有限公司 | 注册人 | - |
4 | 华润广东医药有限公司 | 经营企业 | 国家药监局公布的示范单位 |
5 | 华润广州医疗器械有限公司 | 经营企业 | - |
6 | 华润深圳医药有限公司 | 经营企业 | - |
7 | 国药集团广东省医疗器械有限公司 | 经营企业 | - |
8 | 国药控股广州有限公司 | 经营企业 | - |
9 | 国药一致医疗器械(深圳)有限公司 | 经营企业 | - |
10 | 中山大学附属第一医院 | 医疗机构 | 国家药监局公布的示范单位 |
11 | 广州医科大学附属第一医院 | 医疗机构 | - |
12 | 中国医学科学院阜外医院深圳医院 | 医疗机构 | - |
13 | 广东省中医院珠海医院 | 医疗机构 | - |
14 | 汕头大学医学院第一附属医院 | 医疗机构 | - |
15 | 华南理工大学附属第六医院(佛山市南海区人民医院) | 医疗机构 | - |
16 | 惠州市第一人民医院 | 医疗机构 | - |
17 | 江门市中心医院 | 医疗机构 | - |
18 | 阳江市人民医院 | 医疗机构 | - |
(六)临床试验相关工作开展基本情况
2022年,广东省新增医疗器械临床试验备案机构13家,如表14所示。
2022年,省药监局办理新增医疗器械临床试验备案项目1541个,其中境内第三类1133个,境内第二类372个,进口第三类32个,进口第二类4个。
表14 2022年度广东省新增备案机构名单
序号 | 备案号 | 机构名称 |
1 | 械临机构备202200016 | 深圳市宝安区人民医院 |
2 | 械临机构备202200050 | 广州市花都区人民医院 |
3 | 械临机构备202200062 | 中山火炬开发区人民医院 |
4 | 械临机构备202200065 | 惠州市第一人民医院 |
5 | 械临机构备202200066 | 南方科技大学医院 |
6 | 械临机构备202200071 | 深圳市龙岗区耳鼻咽喉医院 |
7 | 械临机构备202200073 | 茂名市中心血站 |
8 | 械临机构备202200077 | 深圳市龙岗中心医院 |
9 | 械临机构备202200081 | 广州市番禺区妇幼保健院 |
10 | 械临机构备202200098 | 深圳市龙华区人民医院 |
11 | 械临机构备202200102 | 佛山市三水区人民医院 |
12 | 械临机构备202200114 | 深圳市血液中心 |
13 | 械临机构备202300003 | 珠海市第三人民医院 |
(七)医疗器械注册优先审批基本情况
2022年,广东省医疗器械注册优先审批申请量为78项。广东省进入国家药监局优先审批程序的有2项,进入省药监局优先审批程序的有17项,如表15、表16所示。
表15 2022年度进入国家药监局优先审批程序项目
序号 | 产品名称 | 申请人 |
1 | 人类ONECUT2/VIM基因甲基化检测试剂盒(荧光PCR法) | 广州市基准医疗有限责任公司 |
2 | 人类免疫缺陷病毒1型(HIV-1)核酸定量检测试剂盒(PCR-荧光探针法) | 广州达安基因股份有限公司 |
表16 2022年度进入省药监局优先审批程序项目
序号 | 产品名称 | 申请人 |
1 | 医用诊断X射线管组件 | 珠海瑞能真空电子有限公司 |
2 | 全数字彩色多普勒超声诊断系统 | 汕头市超声仪器研究所股份有限公司 |
3 | 便携式数字化X射线摄影系统 | 汕头市超声仪器研究所股份有限公司 |
4 | 血气生化分析仪 | 深圳市理邦精密仪器股份有限公司 |
5 | 血气生化试剂盒(干化学法) | 深圳市理邦精密仪器股份有限公司 |
6 | 一次性使用动脉采血器 | 深圳市理邦精密仪器股份有限公司 |
7 | 一次性使用末梢采血管 | 深圳市理邦精密仪器股份有限公司 |
8 | 醛固酮(ALD)测定试剂盒(化学发光免疫分析法) | 深圳迈瑞生物医疗电子股份有限公司 |
9 | 尿液有形成分分析仪 | 深圳迈瑞生物医疗电子股份有限公司 |
10 | 全自动尿液分析系统 | 深圳迈瑞生物医疗电子股份有限公司 |
11 | 全自动干化学尿液分析仪 | 深圳迈瑞生物医疗电子股份有限公司 |
12 | 4K内窥镜荧光摄像系统 | 深圳迈瑞生物医疗电子股份有限公司 |
13 | 医用内窥镜冷光源 | 深圳迈瑞生物医疗电子股份有限公司 |
14 | 色素浓度图分析仪 | 深圳市金迈得医疗科技有限公司 |
15 | 多体位上下肢运动康复训练与评估系统 | 广州一康医疗设备实业有限公司 |
16 | 上下肢主被动运动评估训练仪 | 广州一康医疗设备实业有限公司 |
17 | 语言障碍康复评估训练系统 | 广州一康医疗设备实业有限公司 |
注:本报告的数据统计自2022年1月1日至2022年12月31日。
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习。






















