四川省药品监督管理局药品生产许可信息通告(2023年第8期)
行政许可 企业 四川省
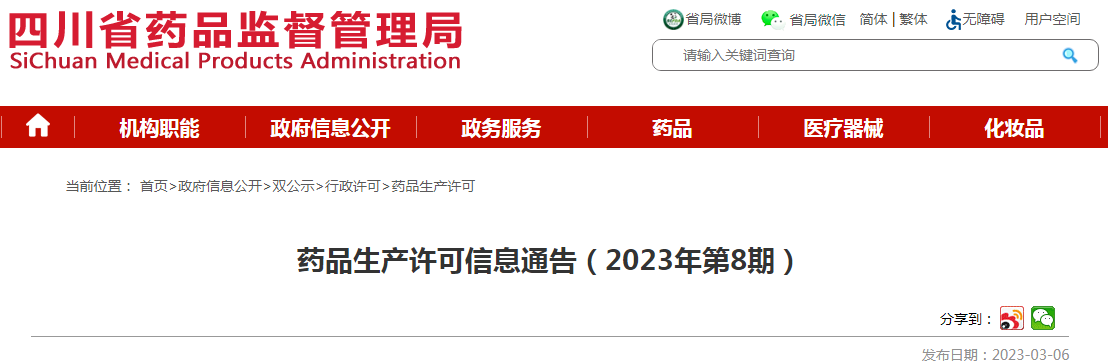
药品生产许可信息通告(2023年第8期,截止2023年3月3日) | |||||||||||
序号 | 项目名称 | 行政相对人名称 | 行政相对人代码_1 (统一社会信用代码) | 法定代表人姓名 | 许可证书(批件)名称 | 行政许可决定书文号 | 许可内容 | 许可决定日期 | 有效期自 | 有效期至 | 许可机关 |
1 | 《药品生产许可证》变更(生产负责人) | 雅安迅康药业有限公司 | 91511826337845535Y | 张海 | 药品生产许可证 | 川20170451 | 同意该企业《药品生产许可证》生产负责人由敬向余变更为纪奇森 | 2023/2/24 | 2023/2/24 | 2027/4/27 | 四川省药品监督管理局 |
2 | 麻醉药品、第一类精神药品和第二类精神药品原料药定点生产并增加生产范围审批 | 四川仁安药业有限责任公司 | 91511621MA62B21D8Y | 何勇 | 药品生产许可证 | 川20170456 | 同意该企业《药品生产许可证》在生产地址“四川省岳池县九龙镇(工业园区)健康路仁安段9号”上增加生产范围:精神药品(咪达唑仑)(仅限注册申报使用),生产车间:101车间、201车间,生产线:咪达唑仑生产线 | 2023/2/27 | 2023/2/27 | 2027/8/30 | 四川省药品监督管理局 |
3 | 取消仅限注册 | 四川远大蜀阳药业有限责任公司 | 91510100202368620M | 冯增辉 | 药品生产许可证 | 川20160237 | 同意该企业《药品生产许可证》生产范围血液制品(人凝血因子Ⅸ)(仅限注册申报使用)变更为血液制品(人凝血因子Ⅸ),并通过药品GMP符合性检查,生产地址:成都高新区安泰五路888号,生产车间:血液制品车间,生产线:蛋白分离区、凝血因子区、蛋白精制区、2号分装线、包装区 | 2023/2/24 | 2023/2/24 | 2025/12/7 | 四川省药品监督管理局 |
4 | 医疗机构制剂室的药检室负责人及质量管理组织负责人变更备案 | 成都市中西医结合医院 | 45075553-1 | 陈泽君 | 医疗机构制剂许可证 | 川20160004Z | 同意该医疗机构《医疗机构制剂许可证》质量负责人由蒲秋易变更为施崇精 | 2023/2/27 | 2023/2/27 | 2025/10/15 | 四川省药品监督管理局 |
5 | 《药品生产许可证》变更(生产负责人) | 四川盛世锦荣药业有限公司 | 915103003457674426 | 胡淑英 | 药品生产许可证 | 川20170443 | 同意该企业《药品生产许可证》生产负责人由陈超变更为郑义 | 2023/2/28 | 2023/2/28 | 2027/3/6 | 四川省药品监督管理局 |
6 | 《药品生产许可证》变更(法定代表人、企业负责人) | 成都康华生物制品股份有限公司 | 91510112758779783Q | 王振滔 | 药品生产许可证 | 川20160271 | 同意该企业《药品生产许可证》法定代表人由王清瀚变更为王振滔,企业负责人由王清瀚变更为王振滔 | 2023/3/1 | 2023/3/1 | 2025/12/9 | 四川省药品监督管理局 |
7 | 《药品生产许可证》变更(生产负责人) | 四川省旭晖制药有限公司 | 91510681054120040U | 高洪波 | 药品生产许可证 | 川20160055 | 同意该企业《药品生产许可证》生产负责人由廖建伟变更为刘兴 | 2023/2/28 | 2023/2/28 | 2025/9/26 | 四川省药品监督管理局 |
8 | 《药品生产许可证》变更(生产负责人) | 四川省通园制药集团有限公司 | 91510681735868644N | 徐成刚 | 药品生产许可证 | 川20160089 | 同意该企业《药品生产许可证》生产负责人由刘兴变更为唐江华 | 2023/2/28 | 2023/2/28 | 2025/11/2 | 四川省药品监督管理局 |
9 | 《药品生产许可证》变更(新建车间生产线) | 国药集团川抗制药有限公司 | 91510100749702784T | 陈茂棠 | 药品生产许可证 | 川20160262 | 同意该企业《药品生产许可证》生产范围原料药(他克莫司)新建车间及生产线:精烘包2(原料药(他克莫司)生产线),仅限注册申报使用 | 2023/2/23 | 2023/2/23 | 2025/11/1 | 四川省药品监督管理局 |
10 | 《药品生产许可证》变更(委托生产) | 成都苑东生物制药股份有限公司 | 91510100689030428K | 王颖 | 药品生产许可证 | 川20160173 | 同意该企业委托成都硕德药业有限公司生产硫酸氢氯吡格雷片(国药准字H20203701),生产地址:成都天府国际生物城(双流区乐康路9号),生产车间:S101车间(口服固体制剂车间),生产线:片剂生产线,药品GMP符合性检查范围:片剂,委托有效期至2025年12月28日,以上委托方或受托方相关资质证明失效,则本许可自然失效;其他内容不变。 | 2023/3/1 | 2023/3/1 | 2025/12/28 | 四川省药品监督管理局 |
11 | 《药品生产许可证》变更(受托生产) | 成都天台山制药有限公司 | 915101832024104543 | 王虎 | 药品生产许可证 | 川20160308 | 同意该企业接受郑州维先医药科技有限公司(注册地址:河南省郑州市航空港经济综合实验区黄海路与生物科技二街交叉口郑州临空生物医药园1号楼1楼)委托生产注射用盐酸罗沙替丁醋酸酯,生产地址为四川省邛崃市天兴大道88号,受托生产车间为针剂Ⅱ车间,生产线为针剂Ⅱ车间冻干2线,仅限注册申报使用。 | 2023/2/28 | 2023/2/28 | 2025/11/17 | 四川省药品监督管理局 |
12 | 《药品生产许可证》变更(增加生产地址和范围) | 成都康诺行生物医药科技有限公司 | 91510100MA6C66PK0M | 徐刚 | 药品生产许可证 | 川20190512 | 同意该企业《药品生产许可证》增加生产地址和生产范围:成都天府国际生物城凤凰路669号:治疗用生物制品(CM310重组人源化单克隆抗体注射液)(仅限注册申报使用),生产车间:N车间,生产线:ND1原液生产线、NP2制剂生产线) | 2023/3/2 | 2023/3/2 | 2024/12/30 | 四川省药品监督管理局 |
13 | GMP符合性检查 | 成都硕德药业有限公司 | 91510100MA62MDED09 | 袁小军 | 药品生产许可证 | 川20210545 | 同意该企业《药品生产许可证》生产范围片剂(仅限注册申报使用)变更为片剂,并通过药品GMP符合性检查,生产地址:成都天府国际生物城(双流区乐康路9号),生产车间:S101车间(口服固体制剂车间),生产线:片剂生产线 | 2023/3/1 | 2023/3/1 | 2026/10/27 | 四川省药品监督管理局 |
14 | GMP符合性检查 | 四川国为制药有限公司 | 91511402575264955M | 郭礼新 | 药品生产许可证、药品GMP符合性检查结果通知书 | 川20160129 、川2023031 | 同意该企业《药品生产许可证》生产范围原料药(艾地骨化醇)(仅限注册申报使用)变更为原料药(艾地骨化醇),并通过药品GMP符合性检查,生产地址:眉山市经济开发区新区,生产车间:六车间,生产线:合成线 | 2023/2/27 | 2023/2/27 | 2025/11/2 | 四川省药品监督管理局 |
15 | 《药品生产许可证》变更(受托生产) | 亚宝药业四川制药有限公司 | 9151018274640006XE | 汤柯 | 药品生产许可证 | 川20160257 | 同意该企业接受亚宝药业集团股份有限公司(注册地址:山西省运城市芮城县富民路43号)委托生产葡萄糖酸钙锌口服溶液,生产地址四川省彭州工业开发区柏江北路368号,综合制剂二车间,口服溶液剂生产线,仅限注册申报使用 | 2023/2/27 | 2023/2/27 | 2025/11/15 | 四川省药品监督管理局 |
16 | 《药品生产许可证》变更(增加生产范围) | 泸州科瑞德制药有限公司 | 91510500660250013R | 陈刚 | 药品生产许可证 | 川20160360 | 同意该企业《药品生产许可证》增加生产范围:加生产范围:(以下范围仅限注册申报使用)原料药(盐酸贝尼地平、盐酸贝凡洛尔),,生产车间:五车间,生产线:原料药生产线五 | 2023/2/23 | 2023/2/23 | 2025/11/4 | 四川省药品监督管理局 |
17 | GMP符合性检查 | 四川科创制药集团有限公司 | 9151018220259218X3 | 罗加富 | 药品生产许可证 | 川20220561 | 同意该企业《药品生产许可证》生产范围颗粒剂(含中药前处理和提取)(共用)、硬胶囊剂、原料药(葡甘聚糖粗粉)(仅限注册申报使用)变更为颗粒剂(含中药前处理和提取)(共用)、硬胶囊剂、原料药(葡甘聚糖粗粉),并通过药品GMP符合性检查,颗粒剂(含中药前处理和提取)(共用)生产车间:中药前处理和提取车间、固体制剂一车间,生产线:中药前处理和提取生产线、颗粒剂生产线;硬胶囊剂生产车间:固体制剂二车间,生产线:硬胶囊剂生产线;原料药(葡甘聚糖粗粉)生产车间:原料药车间,生产线:原料药(葡甘聚糖粗粉)生产线 | 2023/2/28 | 2023/2/28 | 2027/4/26 | 四川省药品监督管理局 |
18 | 《药品生产许可证》变更(受托生产) | 成都盛迪医药有限公司 | 915101005696858096 | 王洪森 | 药品生产许可证 | 川20160191 | 同意该企业接受江苏恒瑞医药股份有限公司(注册地址:江苏恒瑞医药股份有限公司)委托生产盐酸左氧氟沙星片(国药准字H19990256、国药准字H20066387)(生产车间:201车间,生产线:固体制剂生产线)、厄贝沙坦片(国药准字H20000513)、盐酸氨溴索片(国药准字H19980016)(生产车间:209车间,生产线:固体制剂生产线),药品GMP符合性检查范围:片剂,委托有效期至2025年11月2日,以上委托方或受托方相关资质证明失效,则本许可自然失效;其他内容不变。 | 2023/2/28 | 2023/2/28 | 2025/11/2 | 四川省药品监督管理局 |
19 | 《药品生产许可证》变更(受托生产) | 成都盛迪医药有限公司 | 915101005696858096 | 王洪森 | 药品生产许可证 | 川20160191 | 同意该企业接受江苏恒瑞医药股份有限公司(注册地址:江苏恒瑞医药股份有限公司)委托生产小儿电解质补给注射液[国药准字H20110045、国药准字H20110046)、加替沙星氯化钠注射液(国药准字H20050755、国药准字H20050842)(生产车间:204车间,生产线:注射剂生产线)、缬沙坦氨氯地平片(I)(国药准字H20203486)(生产车间:201车间,生产线:固体制剂生产线),药品GMP符合性检查范围:大容量注射剂、片剂,委托有效期至2025年11月2日,以上委托方或受托方相关资质证明失效,则本许可自然失效;其他内容不变。 | 2023/2/28 | 2023/2/28 | 2025/11/2 | 四川省药品监督管理局 |
20 | 持有人变更后GMP符合性检查 | 成都欣捷高新技术开发股份有限公司 | 91510100723434670C | 关文捷 | 药品生产许可证、药品GMP符合性检查结果通知书 | 川20210528 、川2023029 | 同意该企业委托四川汇宇制药股份有限公司生产丙戊酸钠注射用浓溶液(国药准字H20223267),生产地址:四川省内江市市中区汉阳路333号3幢,生产车间/生产线:M车间/M车间生产线;注射剂车间(Ⅰ)/注射剂车间(Ⅰ)生产线(灭菌工序),药品GMP符合性检查范围:丙戊酸钠注射用浓溶液,委托有效期至2025年10月18日,以上委托方或受托方相关资质证明失效,则本许可自然失效;其他内容不变。 | 2023/3/1 | 2023/3/1 | 2025/10/18 | 四川省药品监督管理局 |
21 | 《药品生产许可证》变更(场地变更) | 四川仁安药业有限责任公司 | 91511621MA62B21D8Y | 何勇 | 药品生产许可证、药品GMP符合性检查结果通知书 | 川20170456 、川2023030 | 同意该企业《药品生产许可证》生产范围原料药(门冬氨酸鸟氨酸)生产场地由四川省成都市青白江区大弯通站路268号变更至四川省岳池县九龙镇(工业园区)健康路仁安段9号,并通过药品GMP符合性检查,生产地址:四川省岳池县九龙镇(工业园区)健康路仁安段9号,生产车间:205B车间,生产线:门冬氨酸鸟氨酸生产线 | 2023/3/2 | 2023/3/2 | 2027/8/30 | 四川省药品监督管理局 |
22 | 《药品生产许可证》变更(场地变更) | 四川仁安药业有限责任公司 | 91511621MA62B21D8Y | 何勇 | 药品生产许可证、药品GMP符合性检查结果通知书 | 川20170456 、川2023031 | 同意该企业《药品生产许可证》生产范围无菌原料药(替卡西林钠)通过药品GMP符合性检查,生产地址:四川省岳池县九龙镇(工业园区)健康路仁安段9号,生产车间:110车间,生产线:替卡西林钠生产线 | 2023/3/2 | 2023/3/2 | 2027/8/30 | 四川省药品监督管理局 |
23 | 《药品生产许可证》变更(法定代表人) | 四川鑫仁泰药业有限责任公司 | 91510182332004286Y | 杨林 | 药品生产许可证 | 川20160373 | 同意该企业《药品生产许可证》法定代表人由杨林变更为熊华 | 2023/2/28 | 2023/2/28 | 2025/12/29 | 四川省药品监督管理局 |
24 | 《药品生产许可证》变更(质量负责人、质量受权人) | 四川菩丰堂药业有限公司 | 91510181MA63A9PP3T | 黎勇 | 药品生产许可证 | 川20190501 | 同意该企业《药品生产许可证》质量负责人由陈小林变更为姚红琼,质量受权人由陈小林变更为姚红琼 | 2023/3/1 | 2023/3/1 | 2024/4/3 | 四川省药品监督管理局 |
25 | 《药品生产许可证》变更(载明生产车间生产线) | 海思科制药(眉山)有限公司 | 91511402MA6AXG1C5Y | 易仕旭 | 药品生产许可证 | 川20190510 | 同意该企业《药品生产许可证》生产范围(以下范围仅限注册申报使用)乳膏剂(激素类)载明生产车间及生产线:101车间(101车间乳膏/软膏剂生产线),(以下范围仅限注册申报使用)原料药(利多卡因、盐酸乙酰左卡尼汀、维生素B6、丙胺卡因)载明生产车间及生产线:203车间(203车间生产线); | 2023/3/3 | 2023/3/3 | 2024/12/17 | 四川省药品监督管理局 |
26 | 《药品生产许可证》变更(受托生产) | 成都新恒创药业有限公司 | 91510115792159190X | 关文捷 | 药品生产许可证 | 川20160199 | 同意该企业接受北京民康百草医药科技有限公司(注册地址:北京市昌平区科技园振兴路2号院4号楼3层4301)委托生产左西孟旦注射液,生产地址为成都市温江区成都海峡两岸科技产业开发园区海科路西段459号,受托生产车间为小容量注射剂车间,生产线为西林瓶生产线,仅限注册申报使用。 | 2023/3/3 | 2023/3/3 | 2025/11/17 | 四川省药品监督管理局 |
27 | 《药品生产许可证》变更(新建车间符合性检查) | 四川科伦药业股份有限公司 | 9151010020260067X4 | 刘革新 | 药品生产许可证、药品GMP符合性检查结果通知书 | 川20160001、川2023032 | 同意该企业《药品生产许可证》生产范围原料药(草酸艾司西酞普兰)新建车间生产线,并通过GMP符合性检查,生产地址:成都市邛崃市羊安工业园区羊纵六路3号;生产车间:B车间;生产线:B1线 | 2023/3/3 | 2023/3/3 | 2025/12/27 | 四川省药品监督管理局 |
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习。
热门推荐
最新推荐

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

医疗机构制剂注册备案
1.CIO为医疗机构配制制剂提供一站式合规服务。 2.帮助医疗机构取得医疗机构制剂注册批件。 3.价格合理,服务更省心。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

医疗器械互联网信息服务备案
自2025年1月20日起,国家药监局将“药品、医疗器械互联网信息服务审批”改为备案管理。我们为自建网站或平台销售医疗器械的企业提供专业的医疗器械互联网信息服务备案咨询服务,帮助企业高效完成备案。

药品互联网信息服务备案
自2025年1月20日起,药品和医疗器械互联网信息服务审批不再需要前置审批,转而实行备案管理。我们致力于为药企提供高效、专业的药品互联网信息服务备案服务,帮助客户顺利开展网络销售业务。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。







