
仿制药上市许可申请
1.为医药产品申请在国内上市提供注册咨询服务。 2.帮助客户顺利获取《药物临床试验通知》、《药品注册证书》、《药品再注册批准通知书》或《药品补充申请批准通知书》。
参考价格 ¥0.00 ¥0.00
典型案例 延安药业:仿制药一致性评价



仿制药注册
化学仿制药包括注册分类3类和4类的产品。3类与4类的区别主要看原研产品是否在中国境内上市。即使中国境内已经有仿制药上市多年,只要原研产品从未在中国上市,注册分类就是3类。
仿制药上市许可申请服务范围
CIO提供国内、国外生产化学仿制药的临床试验申请或豁免(如有)、BE试验登记(如有)、上市许可申请、药品上市后变更及再注册申请等服务。
仿制药上市许可申请服务内容
1.为境外药品注册申请提供注册代理服务。
2.药品注册资料差距分析、风险评估,并指导客户进行补充完善。
3.负责外文注册资料的专业翻译、校对。
4.CTD格式注册申请资料编写、审核及递交。
5.eCTD格式出版与提交。
6.全程跟踪CDE审评进度,积极与审评员沟通、回复专家提问。
7.指导CDE技术审评过程中补充资料内容回复及资料递交。
8.注册检验申请、送样、跟踪及问题解决。
9.如有需要,可协助GMP部门为现场核查提供服务。
10.已上市药品的变更维护,包括审批类变更、备案及年报。
11.已上市药品再注册申请。
仿制药注册收费标准
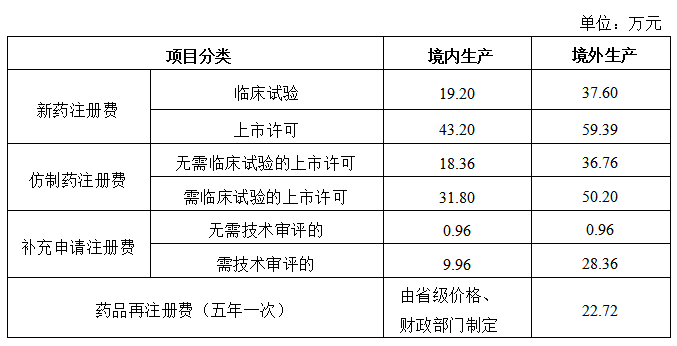
注:《药品注册收费标准》与《药品注册收费实施细则》自2020年7月1日起施行。
分享










