2023药品注册申请受理与申请审评审批情况数据概况
CIO专家-山丹
一、药品注册申请受理情况
2023年,药品注册申请申报量持续增长,药审中心受理各类注册申请18503 件(同比增加 35.84%,以受理号计,下同),包括药品制剂注册申请16898件(同比增加36.63%),化学原料药注册申请1605件(同比增加28.09%)。16898件药品制剂注册申请包括技术审评类注册申请 13153 件(同比增加 41.41%,包括 13144 件药品,9 件药械组合),直接行政审批类注册申请 3745 件(同比增加 22.11%,包括补充申请和一次性进口)。2019年至2023年注册申请受理情况详见图1。
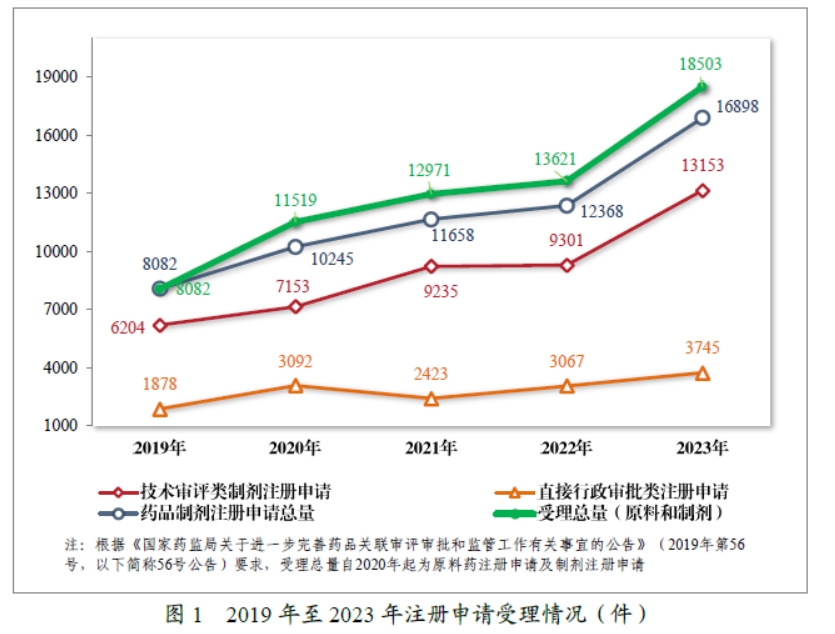
2023 年受理的 13144 件技术审评类药品注册申请中,以药品类型统计,中药注册申请 1163 件,同比增加 176.25%;化学药品注册申请 9813 件,同比增加 39.11%,占全部需技术审评的药品注册申请受理量的 74.66%;生物制品注册申请 2168 件,同比增加 19.12%。2019 年至 2023 年需技术审评的各药品类型注册申请受理情况详见图2。
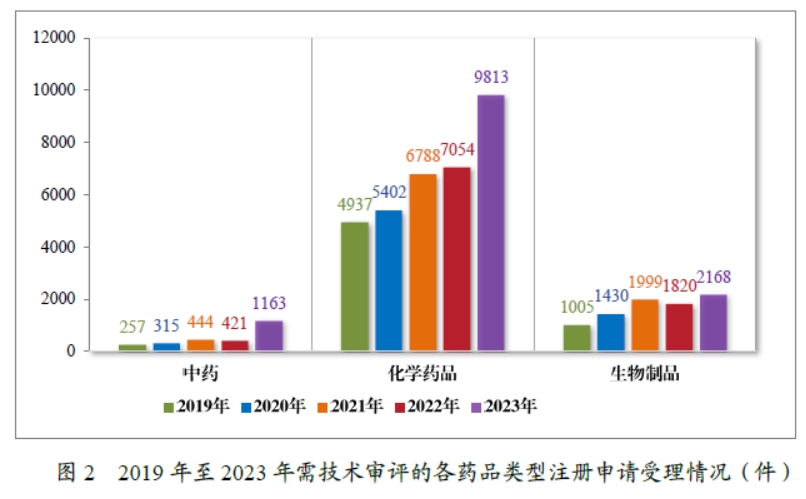
以注册申请类别统计,受理新药临床试验申请(该注册申请类别以下简称“IND”)2997 件,同比增加 33.56%;验证性临床试验申请170 件,比 2022 年增加 32.81%;新药上市许可申请(该注册申请类别以下简称“NDA”)470 件,同比增加 40.72%;同名同方药、化学仿制药上市许可申请(该注册申请类别以下简称“ANDA”)3852 件,同比增加 66.25%;仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称“一致性评价申请”)1006 件,同比增加 20.48%;补充申请 4115 件,同比增加 36.26%;境外生产药品再注册申请 534 件,同比增加 28.06%。2019 年至 2023 年需技术审评的各类别注册申请受理情况详见图 3。
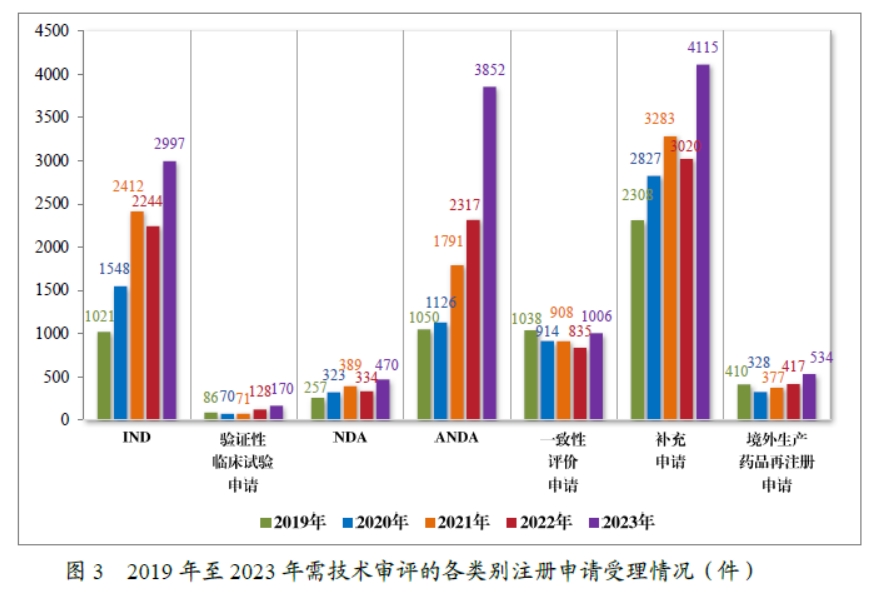
二、药品注册申请审评审批情况
2023 年,药审中心审结3注册申请共 15713件( 同比增加 28.80%),包括药品制剂注册申请 14523 件(同比增加 27.79%),化学原料药注册申请 1190 件(同比增加 42.51%)。14523 件药品制剂注册申请包含技术审评类注册申请 10642 件(同比增加 25.75%,包括 10633 件药品,9件药械组合),直接行政审批类注册申请3881件(同比增加33.74%)。2019 年至 2023 年注册申请审结量详见下图。
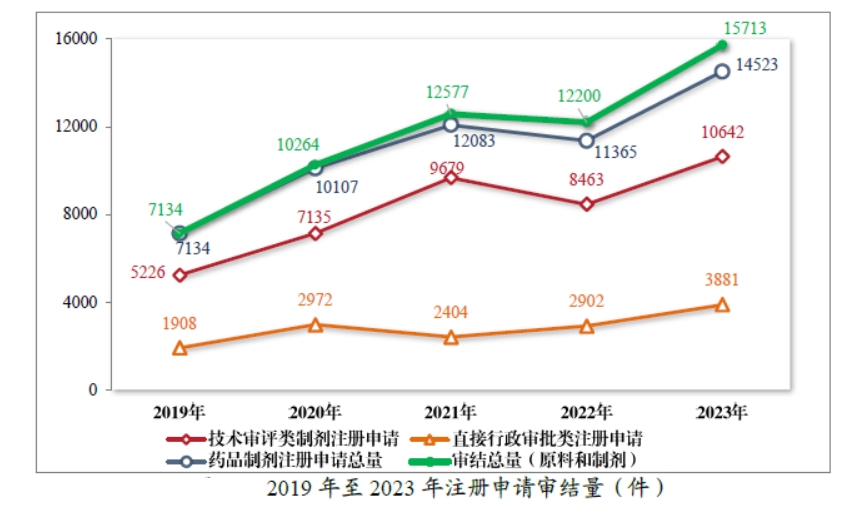
截至 2023 年底,在审和待审的注册申请共11059件,其中包含原料药注册申请 2148件;待申请人回复补充资料的注册申请共2153件,其中包含原料药注册申请 622 件。2023 年审结的 10642件技术审评类注册申请中,按药品类型计,中药注册申请 878 件,同比增加 131.05%;化学药品注册申请 7725件,同比增加 24.88%,占全部需技术审评审结量的72.59%;生物制品注册申请 2030件,同比增加 7.41%;药械组合注册申请9件。2019年至 2023 年需技术审评的各药品类型注册申请审结情况详见下图。
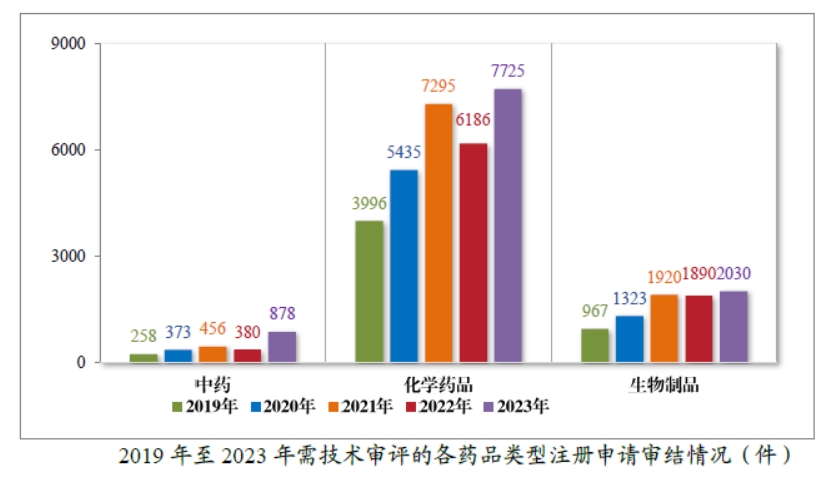
按审评序列计,2023 年审结 IND 2724 件,同比增加18.43%;验证性临床试验申请 168 件,同比增加 22.63%;NDA 427 件,同比增加 26.71%;ANDA2241件,同比增加60.76%;一致性评价申请990件,同比增加 7.26%;补充申请 3541件,同比增加20.03%;境外生产药品再注册申请 538 件,同比增加 29.95%。2019 年至 2023 年需技术审评的各类别注册申请审结情况详下图。
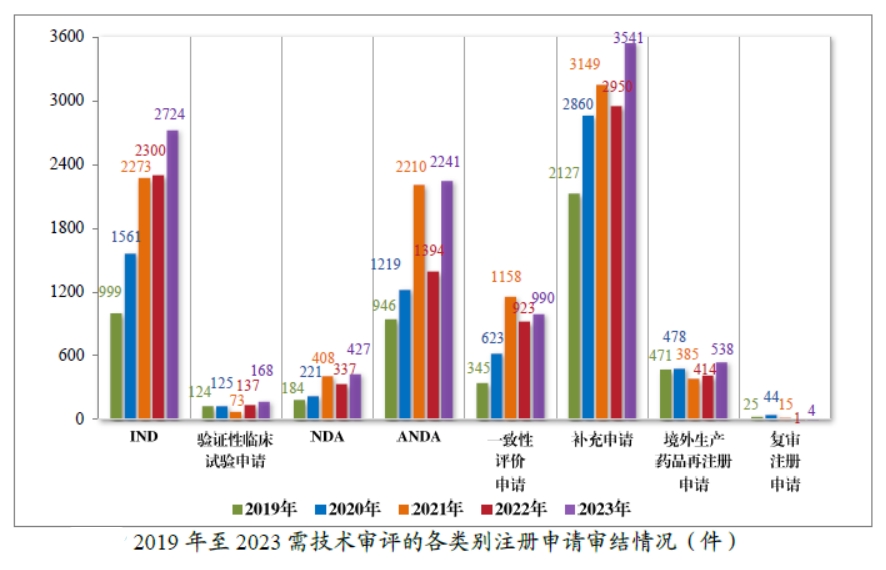
2023 年,药审中心采取多种措施提高审评效率,加快药品审评速度,以临床价值为导向,为患者提供更多的用药选择。
全年批准上市1类创新药 40个品种(详见附件1),其中9个品种(22.5%)通过优先审评审批程序批准上市,13个品种(32.5%)为品附条件批准上市,8个品种(20%)在临床研究阶段纳入了突破性治疗药物程序、4个新冠治疗药物(10%)通过特别审批程序批准上市。
全年批准罕见病用药 45 个品种(未包括化药4类罕见病用药),其中 15 个品种(33.3%)通过优先审评审批程序得以加快上市(详见附件2),1个附条件批准上市。
全年批准儿童用药产品 92个品种,包含72个上市许可申请,其中 26 个品种(28%)通过优先审评审批程序得以加快上市(详见附件3);另批准20个品种扩展儿童适应症,让更多儿童患者和千万家庭从中受益。
全年批准CAR-T细胞治疗产品3个,包括附条件批准伊基奥仑赛注射液、纳基奥仑赛注射液上市,附条件批准阿基仑赛注射液增加新适应症。
全年批准境外已上市、境内未上市的原研药品( 化学药品 5.1 类、生物制品 3.1类)86 个品种,其中 62 个为新批准上市,包括1个纳入临床急需境外新药名单内的品种,24 个为新增适应症。
数据来源:国家药品监督管理局药品审评中心
相关文件下载、服务及学习课程:
药品注册咨询:药品注册申请办理
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。





