药物上市前安全性评价重要考虑
CIO专家-山丹
前言
药物上市前安全性风险预测的关键内容包括:作用机制和类效应、临床前动物毒理学研究、在健康志愿者和患者中的早期安全性和耐受性临床研究,以及来自大中型随机对照临床试验的安全性数据。由于上市前临床试验设计通常是基于有效性而非安全性,因此对于判断不良事件与药物之间的因果关系具有挑战性。
在上市前充分评价药物安全性将有助于药品监管机构权衡获益和风险并尽早作出批准决定。本文总结美国上市前临床安全性评价的最新实践,以供参考。
安全性数据分析与呈现
对于临床试验整体不良事件(AE)数据的分析,一种常见的方法是比较不同治疗组别之间的不良事件发生率。当特定不良事件在治疗组之间的频率存在显著差异时,这可能会升级为安全信号。然而,对于多大程度的差异才能被视为信号尚未明确定义,仍然需要进行临床判断。有几种方法可以提高审评人员对具有最大差异幅度的不良事件术语的关注。
AE发生率表通常按风险差异排序;即依据不良事件术语在治疗组之间的频率差异的绝对值进行排序,见下图。FDA medical reviewer's guidance建议审评人员首先需关注那些发生率≥5%且比安慰剂发生率高2倍,或其他百分比的事件。此外,风险比也可以用作排序工具。风险比通常是药物治疗组中不良事件的频率除以对照组的不良事件频率。例如,如果室速的频率在活性药物组中为5.3%,在安慰剂组中为2.7%,则风险比为5.3%/2.7%或2。风险比可以与风险差异相结合,对AE频率表进行排序,从而将具有最大差异幅度的事件呈现,成为重点关注的AE。例如,在tafamidis临床审评报告中,医学审评员按发生率> 5%,风险差异≥2%和风险比≥1.2与安慰剂组相比对AE进行了排序。
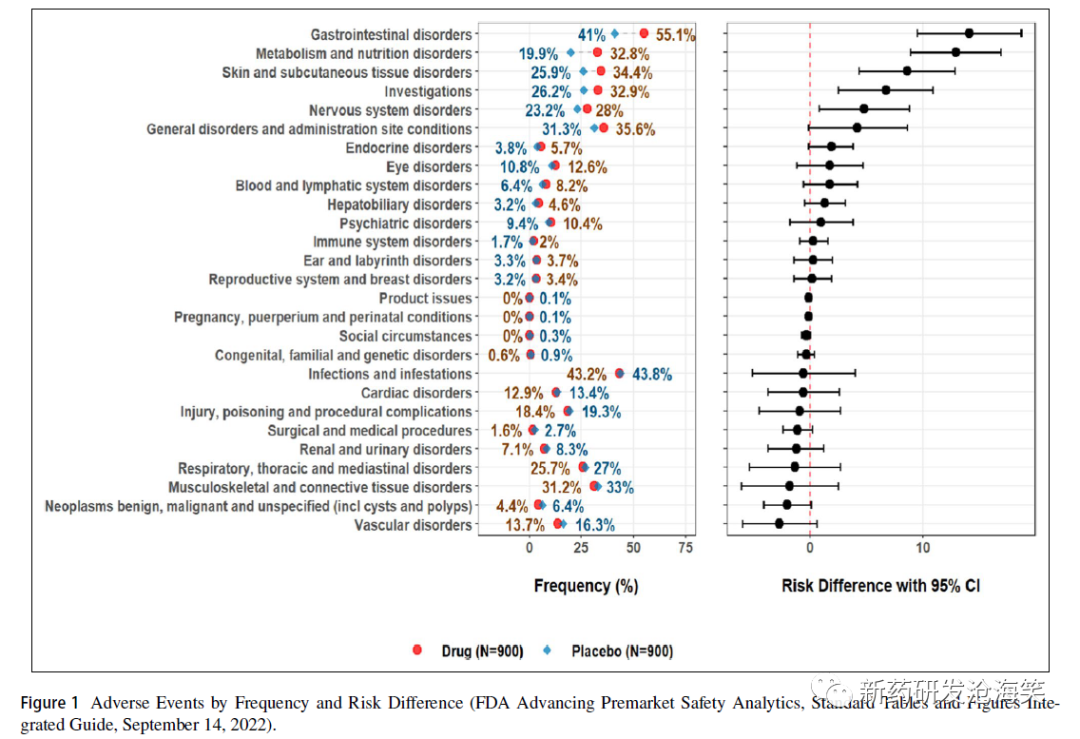
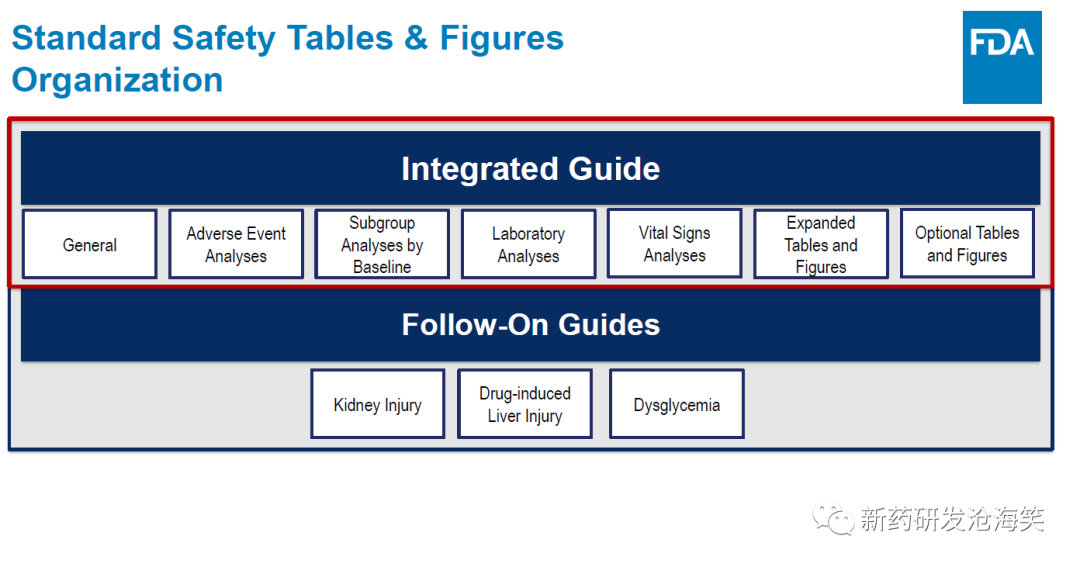
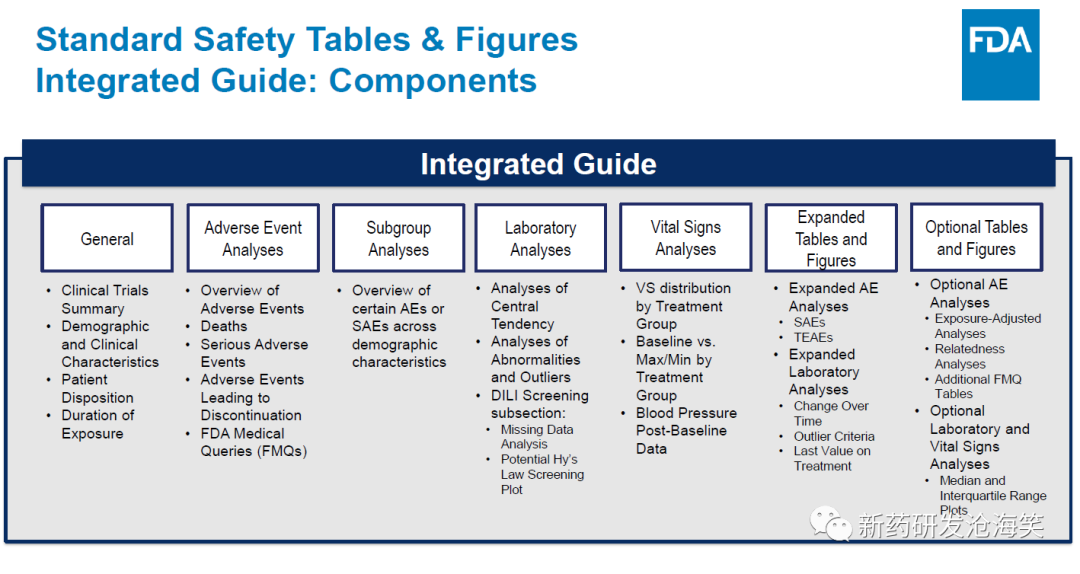
安全性表格按风险差异的大小进行排序,以治疗组为基础,显示不良事件频率和相应对照组的风险差异(上图)。这使审评人员能够快速识别在治疗组之间频率差异最大的事件。FDA 发布了"The Standard Safety Tables and Figures Integrated Guide"对标准安全表格和图形的建议之一是按风险差异的降序显示AE和频率(见下两图)。这样的呈现不仅有助于安全临床医生进行审查,集中注意力于最有可能代表安全信号的事件,而且帮助申请人在上市申请中按照FDA倾向的方式准备数据。FDA 标准安全性图表的建议如下图:
SMQ和FMQ
在评估不良事件频率时,重要的考虑因素是不要将分析限制在单个事件上。虽然在MedDRA首选术语(PT)的创始时期,它旨在表示单个医学概念,但并非总是如此。PT“腹痛”、“上腹痛”和“下腹痛”都是独立的首选术语,但都包含腹痛的医学概念。因此,基于单个首选术语的频率分析可能会误代表它旨在表征的医学概念的实际频率。解决这个限制的一种方法是将临床SOC中的首选术语与相应的各类检查SOC中的术语结合使用(如果适用)。例如,“代谢和营养紊乱SOC”的MedDRA首选术语“低钾血症”将与“血钾降低”各类检查SOC结合使用,以更好地表示钾降低的频率。当然,这两个术语的频率不能简单地相加,因为一个受试者可能报告了两个术语,这将导致重复计数。
StandardMedDRA Queries(SMQ)是将多个相关首选术语的聚合。诚然,SMQ将多个首选术语聚合成代表各种医学状况的术语列表;然而,它包含的术语数量很多,使得这样的工具相当不具体。MedDRA MSSO指出:“SMQ可能是非常具体的术语和不太具体的术语的组合,它可能与特定不良事件和药物暴露相关联的整体临床综合征描述一致。”SMQ这样的广泛可能会提高发现所关注的不良事件的灵敏度,但以牺牲特异性为代价。一个更有针对性的首选术语列表,与感兴趣的医学状况密切匹配,可能在评估相对事件频率时更有价值。
近期,FDA提倡使用FDA medical queries(FMQ)这种方法,FMQ是表示共同医学概念的相对较小的首选术语聚合。例如,“焦虑”的事件相对频率并不能完全解释与焦虑相关事件的其他情况。焦虑FMQ包括“焦虑”、“广泛性焦虑障碍”、“紧张”、“惊恐发作”和“惊恐障碍”的首选术语。对这些组合术语的相对频率进行分析将提供更好的估计该医学概念发生的情况,而不是整体概念的单一表示。当使用单个术语时,事件频率之间的差异可能不存在,但是当使用聚合术语方法时,可能会出现未见过的差异。与SMQ类似,FMQ也有狭窄和广泛版本;但是,使用狭窄FMQ相对较小的大小来发现估计提供了约90%的概率该医学概念已经发生。FDA还开发“算法”FMQ,将首选术语与实验室数据和时间信息相结合。(见下图)



SMQ作为开发的工具,旨在监测药物安全性,促进MedDRA编码数据的检索,用于药物监管和临床开发。相反,FMQ专门用于评估临床开发中新药和生物制品的安全性。数十名FDA医学专家为FMQ的开发做出了贡献,目前有104条。SMQ与FMQ的区别以及FMQ条目(分别见以下两表)。


许多公司已经使用内部衍生的事件术语组合来进行分析,但FDA正式发布的FMQ提供了一种更标准化的方法来进行这种分析,鼓励申请人摆脱仅基于“不良事件”的安全分析,而是转而考虑以“不良效应”为基础的安全性,其中不良效应可以由一个或多个不良事件以及涉及实验室参数和/或生命体征的不良效应来表征。
不良事件因果关系评估
因果分析方法有多种,从临床判断到各种算法到贝叶斯方法。所有这些方法都有局限性。临床判断存在不同研究者之间的判断存在较大的差异,算法基本上是用于为个例安全性评估而开发的任意评分系统,这对于整体安全性数据评估来说是不合适的,而贝叶斯方法对于大多数申请人来说实际应用是有限的。
在评估整体安全数据时,有两个有用的标准来评估因果关系:CIOMS VI和FDA 因果关系评估标准。CIOMS VI因果关系评估标准涵盖了个例评估、整体数据评估和之前发生的不良事件或同类药物。在整体数据评估方面,CIOMS建议考虑以下7个标准:1)该事件是否是药物过量的已知后果,2)该事件是否在未经治疗的患者中罕见,3)该事件是否常见与药物相关,4)是否有药代动力学证据支持关联(包括药物相互作用),5)是否存在可能产生该事件的已知作用机制,6)该事件是否是该类药物的已知效应,7)在动物和非临床研究中是否发现类似的结果。其次,FDA’s draft guidance for Sponsor Responsibilities-Safety Reporting Requirements and Safety Assessment for IND and Bioavailability/Bioequivalence Studies 列出了9个因素,用于评估药物与不良事件之间是否存在因果关系:1)试验组中发生率(事件)增加程度与对照组相比,2)剂量反应关系的证据,3)时间关系,4)试验组中事件发生率在多个试验中的一致性,5)存在可能产生该事件的合理作用机制,6)非临床证据支持发现,7)药物的药理学和已知类效应支持关系,8)研究人群中事件模式(例如,在易感群体中频率更高),以及9)其他潜在相关不良事件的发生(例如,在卒中中发生短暂性缺血性发作,在横纹肌溶解症中发生肌酸激酶升高)。1965年,Bradford Hill爵士引入了他的证据框架,以考虑确定观察到的关联是否可以得出因果关系。他提出的例子是吸烟导致癌症的风险,但自那时以来,这种方法已经表明它也适用于药物与不良事件的因果评估。以下表格是三种方法因果关系的比较。

总结:
监管机构提供了数据呈现和分析方面的考虑因素,如标准化的安全性图表以及FMQ,药物安全审阅者可以将其纳入常规安全监测过程中。在确定值得进一步评估的安全信号后,需要权衡支持或反驳因果关系的证据。CIOMS、FDA和Bradford Hill提供提供了因果关系判断的框架。
考虑到药物研发主要关注有效性而非安全性,因此上市前安全性评价通常是探索性的。虽然上市前临床试验可以描述常见的不良事件概况,并识别一些严重的不良事件,但是即使结合非临床数据进行综合评价,也很少能够完成全面评价药物安全性的任务。因此,只有通过上市后监测才能真正全面了解药物的安全性风险。上市前临床试验有助于识别在上市后监测中应重点关注的目标区域。
*本文转载自微信公众号 - - 新药研发沧海笑
相关文件下载、服务及学习课程:
合规培训:AAV基因治疗产品CMC开发的合规实践
委托定制:药品生产许可证办理
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点






















